年 龄 相 关 性 黄 斑 变 性(age‑related macular degeneration,AMD)是老年人群低视力乃至失明的主要原因[1] ,2040 年全球 AMD 患者数量预计将达到 2.88 亿例[2‑3] 。我国 70 岁以上人群 AMD 的患病率为 20.2%[3] ,随着我国人口老龄化的加剧,AMD的患者数量也在持续上升。
2013 年国际 Beckmann AMD 分类研究小组根据临床表现,将AMD分为无明显年龄性改变、正常年 龄 性 改 变 、早 期 AMD、中 期 AMD 和 进 展 期AMD[4]。 年 龄 相 关 性 眼 病 研 究(Age‑related Eye Disease Study,AREDS)小 组 的 AMD 分 期 标 准 与 Beckmann分期类似[5] 。进展期AMD又分为地图样萎缩(geographic atrophy,GA)和新生血管性 AMD,新生血管性 AMD也称为渗出性或湿性AMD,占AMD 的 10%~20%[1]。随着相干光层析成像术(optical coherence tomography,OCT)的应用和 AMD研究深入,国际 AMD 命名共识研究组于 2020年更新了新生血管性 AMD 黄斑区新生血管(macular neovascularization,MNV)的分型,根据 OCT 图像中 MNV的起源和位置,将其分为1、2和3型[6] 。
除了 AMD 相关分型更新,近 10 年眼底影像学检查技术和设备也飞速发展,相干光层析血管成像术 (optical coherence tomography angiography,OCTA)等多模影像为AMD的诊断和随访提供了新的视角和工具[7‑8] ;在新生血管性AMD的治疗方面,单克隆抗体类和融合蛋白类抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物不断更新和发展,不同的给药方案和随访间隔也为患者提供了更为多样的干预策略[9‑11] 。在强调精准、个体化治疗的时代,对于疾病的不同阶段需要选择合适的检查和治疗方案,这对眼底病医师提出了更高要求,也给临床工作带来了新的挑战。
然而,目前我国眼科医师对于AMD新的分型、检查设备和干预策略的认识尚不充分,眼底病医师与眼科其他亚专科医师对 AMD 的认知存在差距,各地区、各层级医院 AMD 的检查设备等硬件设施以及防治理念和水平等不同,因此 AMD 的规范诊疗亟待加强和完善。基于此,为了更好地指导我国眼科医师开展相关临床工作,中华医学会眼科学分会眼底病学组、中国医师协会眼科医师分会眼底病学组与国家眼部疾病临床医学研究中心,基于最新循证医学证据,结合国际指南和我国社会经济发展现状,在2013 年《中国年龄相关性黄斑变性临床诊断治疗路径》[12] 基础上,于 2023 年制订我国 AMD 临床诊疗指南,以期有助于规范我国 AMD 的诊断、治疗、预防和随访工作。
一、指南制订方法
(一)指南制订的理论依据和方法学本指南由中华医学会眼科学分会眼底病学组和中国医师协会眼科医师分会眼底病学组发起制订,证据质量和推荐意见强度的评价方法采用GRADE(grading of recommendations,assessment,development and evaluation,推荐分级的评估、制订与评价)系统(表 1)[13‑16] ,由宁波诺丁汉 GRADE 中心提供方法学支持。指南设计与制订步骤依据世界卫生组织(world health organization,WHO)发布的《世界卫生组织指南制订手册》,参考美国医学科学院提出的临床实践指南定义[17] 以及 2016年中华医学会发布的《制订/修订〈临床诊疗指南〉的基本方法及程序》[18]。本指南已在国际实践指南注册与透明化平台(http://www.guidelines‑registry.cn)注册(注册号:IPGRP‑2021CN111)。
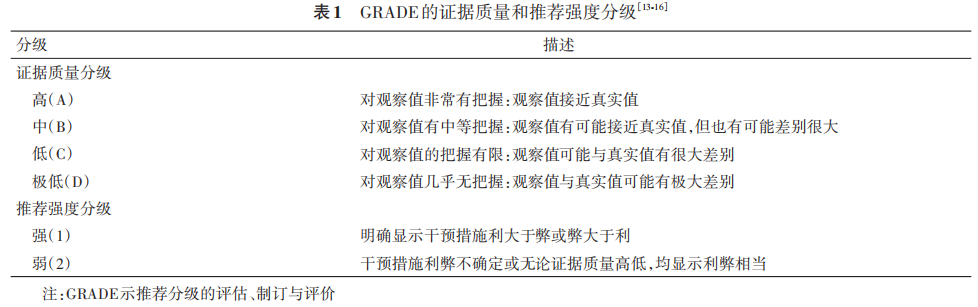
GRADE是目前使用最广泛的证据评价和推荐意见分级系统,包括 2 个部分。第 1 部分为证据评价,根据证据中的偏倚风险、不一致性、间接性、不精确性和发表偏倚,将证据质量分为高、中、低和极低 4 个水平。第 2 部分为推荐意见分级,参考医学干预的利弊平衡、证据质量、价值观念与偏好以及成本与资源耗费等因素制订推荐意见,并将推荐意见分为强推荐和弱推荐(有条件推荐)2 种。医学干预的利弊差别越大,证据质量越高,价值观念与偏好越清晰越趋同,成本与资源耗费越小,则越应为强推荐;反之,则应为弱推荐(有条件推荐)[15‑16] 。强推荐代表绝大多数甚至全部目标群体的医学决策应遵循推荐意见;弱推荐代表推荐意见应有条件适用于目标群体,并应考虑医患共同决策(表1)。
(二)指南使用者和目标人群
本指南供我国从事眼科专业的临床医师及与AMD健康管理相关的专业人员使用。指南推荐意见的主要应用目标人群为我国AMD患者。
(三)指南工作组
指南工作组由指南指导委员会、指南共识专家组、指南制订工作组(包括指南学术秘书组和证据评价组)及指南外审专家组构成。参与指南制订的工作人员均由首席临床专家和方法学专家推荐。指南共识专家组和指南外审专家组成员由来自全国24个省或直辖市的80余名眼科专家和循证医学专家组成。
(四)利益冲突说明
依据WHO以及国际指南联盟的利益冲突管理指导原则,对参与指南制订的工作人员进行利益冲突管理,均向中华医学会眼科学分会提供《个人利益冲突声明表》(包含财务和专业相关的利益冲突内容),均不存在利益冲突。
(五)临床问题遴选和确定
指南指导委员会和指南共识专家组对AMD诊疗相关临床问题进行探讨。以最初提出可能相关的临床问题为基础,使用在线调查形式对所有指南共识专家组和指南外审专家组成员进行调查。随后由指南指导委员会、指南共识专家组和指南学术秘书组召开会议,对最初临床问题进行多轮修改和讨论,最终确定拟解决的8个临床问题,其中1个临床问题聚焦于 AMD 诊断,其余 7 个临床问题聚焦于AMD治疗。指南指导委员会和指南共识专家组通过讨论,针对每个临床问题选取了对推荐意见至关重要(以*表示)及重要的临床结局(观测时间点均为1 年及以上)。(1)针对诊断临床问题:诊断方法的灵敏度和特异度*,不良事件发生率*(包括严重的眼部不良事件、严重的系统性不良事件等),经济学指标;(2)针对治疗临床问题:最佳矫正视力(best corrected visual acuity,BCVA)字母数较基线水平的平均变化值*,至少改善5、10、15个BCVA字母数患者的占比*,至少丢失5、10、15个BCVA字母数患者的占比*,中央视网膜厚度(central retinal thickness, CRT)较 基 线 水 平 的 变 化 值 ,色素上皮脱离(pigment epithelial detachment,PED)高度较基线水平的平均变化值,PED 消退率,治疗次数,治疗后OCT 检查显示无神经上皮内或神经上皮下积液的患者人数,生活质量,严重的眼部不良事件发生率,严重的系统性不良事件发生率,抗血小板研究协作组事件,经济学指标。
(六)证据检索
1. 文献检索:指南证据评价组针对最终纳入的临床问题和结局指标,按照人群(population,P)、干预(intervention,I)、对 照(comparator,C)、结 局(outcome,O)进行解构。对相关研究证据进行系统且全面检索。检索中国知网、万方数据知识服务平台、维普论文检测系统和中国生物医学文献服务系统等中文数据库,以及 PubMed、Embase、Web of Science、the Cochrane Library 等英文数据库。检索时间跨度为自建库至 2022 年 6 月 1 日。除数据库检索外,同时检查国内外相关指南、系统评价中的纳入研究,以及指南指导委员会、指南共识专家组和指南学术秘书组成员补充的相关关键研究,以最终确定符合纳入标准的研究。
2. 文献筛查提取与质量评估:事先针对每个临床问题制订纳入和排除标准,并设计数据提取表格。优先纳入随机对照试验(randomized controlledtrial,RCT);缺乏RCT证据时,根据证据强度补充纳入非 RCT 或非对照研究证据。由 2 名指南证据评价组成员独立进行文献筛查(根据文题、摘要及全文)及数据提取工作,由第 3 名指南证据评价组成员协助解决出现的分歧。采用 Cochrane 偏倚风险评估工具[19] 对纳入的RCT实施风险偏倚评估;采用Newcastle‑Ottawa 量 表 (Newcastle‑Ottawa Scale,NOS)对纳入的非随机对照研究(如队列研究、病例对照研究、自身前后对照研究)进行风险偏倚评估[20] 。
(七)证据评价和推荐意见形成
在针对每个临床问题进行证据汇总时,使用GRADEpro 指南开发工具(www.gradepro.org)构建GRADE 证 据 概 要 和 证 据 到 决 策(evidenc to decision,EtD)框架,总结系统评价的结果[13‑14,16] 。每个临床问题对应的 EtD 表格均包括与干预和对照措施相关的有效性和安全性、资源使用(医疗费用等)、成本效益、患者价值和偏好、对卫生公平性的影响、可接受度和可行性等部分。
指南指导委员会及指南共识专家组通过多轮线上视频讨论会和线下专家共识会,审阅和讨论了指南证据评价组提供的关于 AMD 诊断、治疗等方面的国内外循证医学证据概况、证据的质量或可信度以及EtD表格。最终使用GRADE系统进行临床推荐意见强度评级。指南指导委员会和指南共识专家组以讨论和投票相结合的方式,就推荐意见的方向和强度以及相关使用注意事项达成共识。
(八)外部评审
推荐意见达成共识并形成文字初稿后,提交指南外审专家组进行评审。
(九)指南的传播和实施
本指南发布后,将主要通过以下方式进行传播、实施和评价:(1)在《中华眼科杂志》发表本指南全文,包括本指南制订的具体方法、步骤以及指南工作组的成员和分工。(2)在全国性学术会议中宣讲,为从事 AMD 诊疗工作的眼科医师解读本指南内容并进行相关培训;(3)在国内部分省(市)有计划组织针对本指南内容的推广会议,推动临床眼科医师全面、准确掌握和应用本指南;(4)通过线上多媒体形式推广本指南内容;(5)在未来 2 年定期开展相关研究,对国内 AMD 诊断和治疗现状进行评价,进一步了解本指南实施后的传播应用价值和对
二、AMD的流行病学特征
AMD是全球范围内导致严重及不可逆性视力损伤的主要原因之一[2] 。全球 AMD 的总患病率约为 8.69%(年龄范围为 45~85岁)。预计到 2040年,患者数量将增长至2.88亿例[2] 。临床决策的作用。
我国 AMD 的患病率从 45~49 岁人群的 2.44%逐渐提升至85~89岁人群的18.98%。早期AMD的患病率为 1.79%~10.05%,进展期 AMD 的患病率为0.38%~3.88%;在进展期AMD患者中,GA的患病率为 0.15%(45~49 岁人群)~1.09%(85~89 岁人群),新生血管性 AMD 的患病率为 0.24%~2.79%[21] 。我国 AMD 患者数量从 1990 年的 1 201 万例增加至2015 年 的2 665万 例 ,预计到2050年 将 增 加 至5 519 万例[21]。在地区分布方面,我国中南部地区AMD 患者数量最多(2010年为 752 万例),西北地区最少(2010年为95万例)[21] 。随着我国社会老龄化进程发展,未来 AMD 导致的社会经济负担将进一步加重。
2020年,全球 50岁及以上人群因 AMD致盲人数约为180万,导致中度及重度视力损伤的人数约为620万[22] 。在我国,AMD也是引起视力损伤的主要原因之一。一项针对1990至2019年我国视力障碍和失明人群的研究结果显示,由 AMD 导致的中至重度视力损伤以及致盲的人数分别为 228 万及32万[23] 。
三、AMD的危险因素
(一)年龄
AMD 发生和发展的主要危险因素为年龄。AMD 的患病率、发生率及严重程度均随年龄的增长而增高,几乎所有进展期 AMD 均发生在 60岁以上人群中[24] 。在Beaver Dam Eye研究中,75岁及以上人群以下病变的发生率明显高于 43~54岁人群:较大玻璃膜疣(24% 与 1.9%)、软性玻璃膜疣(23% epithelium,RPE)异常(26.6% 与 7.3%)、MNV(5.2%与 0.1%)和 GA(2.0% 与 0)[25] ;此外,Blue Mountains Eye 研究(Blue Mountains Eye Study,BMES)的结果也显示,AMD 所有典型病变的发生率随年龄增长而增加,进展期 AMD 在 55岁以下人群中的发生率为 0,而在 85 岁及以上人群中为 18.5%[26] 。一项针对 1990 至 2013 年欧洲 AMD 患者的荟萃分析结果也显示,早期 AMD 的患病率从 55~59 岁人群的3.5% 逐渐增加至 85 岁及以上人群的 17.6%,进展期AMD的患病率对应从0.1%增加至9.8%[27] 。
(二)种族
不同种族人群的 AMD 患病率有差异。研究结果表明,白色人种 AMD 的患病率高于有色人种[28‑29] 。一项全球性荟萃分析结果显示,欧洲人AMD 的患病率(12.3%)高于亚洲人(7.4%)和非洲人(7.5%),而亚洲人与非洲人的患病率无明显差异[2] 。欧洲人 GA 的患病率高于非洲人和亚洲人,而新生血管性 AMD 在所有种族中的患病率接近[2] 。此外,新生血管性 AMD 的亚型之一,即息肉样 脉络膜血管病变(polypoidal choroidal vasculopathy,PCV)的患病率在不同种族间存在明显差异,亚洲地区的相关报道较多[30] 。Beijing Eye 研究报道中国PCV的患病率为0.3%±0.1%[31] ,在中国PCV占新生血管性AMD的22.3%~43.4%[32‑33] 。
(三)其他危险因素
1. 遗传性因素:遗传学研究证据显示,AMD 家族史可增加AMD的发生风险[34] 。目前研究确认的遗传因子主要包括补体因子 H 的 Y402H 基因、ARMS2 基因、HTRA1 基因等[35‑38] 。以上基因的多态性与 AMD 的发生风险相关,基因与其他风险因素的组合可能进一步增加AMD的患病风险[39] 。
2. 吸烟:吸烟是 AMD的重要危险因素,已被证明可显著增加各种 AMD 的发生风险,且可能存在剂量反应关系[34,40] 。被动吸烟同样可能增加 AMD的发生风险,而戒烟则与 AMD 的进展风险降低相关[40] 。
3. 高 血 压:高 血 压 可 增 加 AMD险[41‑42] ,但部分研究结果显示收缩压升高与 的 发 生 风发生风险降低相关[43] 。由于研究结论不一致 AMD的[43],冠心病等心血管疾病与 AMD 的关系有待进一步探讨。
4. 饮食:多项研究结果显示,AMD 的发生风险降低与富含Omega‑3长链多不饱和脂肪酸食物(如鱼类)的摄入量增加有关[44‑45] 。AMD发生风险增加与摄入多量饱和脂肪和胆固醇以及体质量指数较高有关[46] 。此外,研究结果显示,富含水果、蔬菜、豆类和鱼的地中海饮食与发展为进展期AMD的风险降低相关[47‑48] 。
四、AMD的病理生理改变
AMD 的主要病理生理改变是外层视网膜、RPE、Bruch膜及脉络膜毛细血管层的退行性病变,以黄斑区细胞外沉积物为典型特征。早期病理表现为基板沉积物和基线沉积物[49] 。这两种类型沉积物可能体现了RPE对细胞应激的不同反应,导致了早期 AMD 的主要表现,即玻璃膜疣和 RPE 异常[50] 。基板沉积物主要位于 RPE 细胞膜与 RPE 基板之间,进行性基板沉积物沉积最终引起 RPE 异常。基线沉积物主要由位于 RPE 基板与Bruch膜内胶原层之间的弥漫性膜性碎片集合组成[51] ,基线沉积物聚集融合形成软性玻璃膜疣[51] 。
根据临床表现、大小、位置等不同,玻璃膜疣分为4种类型。
1. 硬性玻璃膜疣:彩色眼底图像中表现为小的(直径<63 μm,相当于视盘边缘视网膜主要静脉直径的一半,或 1/24 视盘直径)[51] 、散在的 RPE 下黄白色沉积物,边缘清晰,在黄斑区及周边视网膜均可见;荧光素眼底血管造影术(fundus fluorescence angiography,FFA)图像中表现为轻度强荧光,吲哚青 绿 血 管 造 影 术(indocyanine green angiography,ICGA)图像中表现为强荧光;组织学检查表现为圆形、边界分明、充满均质透明物质[51] 。硬性玻璃膜疣可以是视网膜组织衰老的表现,也可出现于AMD。
2. 软性玻璃膜疣:位于后极部,尤其黄斑区,彩色眼底图像中表现为较大的黄白色沉积物,中心颜色更白;OCT 图像中表现为较大的 RPE 下沉积,呈高反射;FFA 图像中通常表现为晚期强荧光,ICGA图像中表现为强荧光;组织学检查表现为充满膜性碎片。其发生和发展可能与 RPE 脱离和弥漫性Bruch 膜异常改变有关,可进一步导致脉络膜新生血管(choroidal neovascularization,CNV)、RPE 细胞死亡和GA[52] 。Ferris 等[4]眼黄斑区软性玻璃膜疣伴有双眼黄斑区 在研究中发现单眼和双RPE 异常者,5年内发展为进展期 AMD的风险分别为 25.6%和47.3%,黄斑区软性玻璃膜疣和RPE异常增加了发展为进展期AMD的风险。
3. 表皮玻璃膜疣:彩色眼底图像中表现为黄斑区和周边视网膜大量(数量>50 个)、小的(直径为25~75μm)点状沉积物,易发现;OCT 图像中表现为 早期在彩色眼底图像中不RPE 下长形中等高反射、锯齿状病灶;较大的表皮玻璃膜疣可侵蚀 RPE层,因此每个表皮玻璃膜疣的顶端仅覆盖 1层薄色素上皮,FFA 图像中表现为星空样(密集分布的强荧光点),ICGA 图像中表现为早期强荧光;组织学检查表现为 Bruch 膜内部弥漫性和结节状增厚[51] 。
表皮玻璃膜疣可出现于 AMD、基底膜沉积物相关性疾病(如 2 型膜增生性肾小球肾炎等)和补体因子H基因突变。
4. 视 网 膜 下 玻 璃 膜 疣 样 沉 积 物(subretinal drusenoid deposit,SDD):也称网状假性玻璃膜疣(reticular pseudodrusen,RPD)。沉积物位于视网膜外层与RPE之间,在彩色眼底图像中表现为点状或网状分布,多见于黄斑区,较硬性玻璃膜疣颜色更白、形态更不规则;OCT 图像中表现为最初 SDD 在RPE与椭圆体带之间沉积,而后突破椭圆体带,随后消退;FFA图像中表现为弱荧光或无变化,ICGA图像中表现为中晚期弱荧光;组织学检查表现为RPE细胞内液泡物质从顶端表面释放形成SDD[51] 。SDD与AMD的疾病进展密切相关,SDD是发展为进展期AMD的独立危险因素[53] ,其中点状SDD易进展为新生血管性AMD,而融合性SDD易进展为GA。
GA 的核心机制是 RPE 功能丧失,其特征为Bruch膜严重破坏,RPE和光感受器细胞明显萎缩和丢失,视网膜其他类型细胞(水平细胞、双极细胞和无长突细胞)丢失,脉络膜毛细血管灌注不良以及炎性反应表现突出(在退行区存在大量激活的小胶质细胞和巨噬细胞)[54] 。年龄相关性眼病研究 2(Age‑related Eye Disease Study 2,AREDS2)的结果显示,GA增长速率(经平方根转换)已发生GA的患眼为 0.29 mm/年,新发 GA 的患眼为 0.28 mm/年[55] 。另一项包含 BMES和 Rotterdam 研究的队列研究的GA 增长速率提高与更低的受教育水平,对侧眼存在 GA 或 CNV[57] ,GA 的大小、位置和数量以及遗传因素有关[55] 。
新生血管性AMD的新生血管从脉络膜毛细血管中生长,突破 Bruch膜进入视网膜下或 RPE下间隙。新生血管的生长与促血管生成因子和抗血管生成因子的局部平衡改变有关,如与 VEGF、胎盘生长因子(placental growth factor,PlGF)、血小板衍生生长因子(platelet‑derived growth factor,PDGF)等促血管细胞因子的过表达,以及金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinase,TIMP)等抑制血管生成因子的表达减少[58] 有关,而缺氧和炎性反应可能是导致平衡改变的启动因素[59] 。此外,新生血管主要由增殖的血管内皮细胞组成,作为不成熟的毛细血管,可导致渗漏、出血、水肿、脂质沉积、PED、晚期纤维瘢痕形成等[60] 。
五、AMD的临床表现
(一)临床分期
根据临床表现,AREDS 小组将 AMD 分为无AMD期、早期、中期和进展期。
- 无AMD期:无或仅有少量小玻璃膜疣[1] 。
- 早期 AMD:主要表现为多个小玻璃膜疣(直径<63 μm),较少量中等大小玻璃膜疣(直径为63~124 μm)或轻度RPE异常[1] 。
- 中期 AMD:随时间推移,细胞外沉积物蓄积,色素移行进入视网膜,玻璃膜疣增大,RPE发生色素减退和色素沉着[6] 。主要表现为单眼或双眼存 在 广 泛 的 中 等 大 小 玻 璃 膜 疣(直 径 为 63~124 μm),或至少 1 个大玻璃膜疣(直径≥125 μm),或出现未累及黄斑中心凹的GA[1] 。
- 进展期 AMD:表现为累及黄斑中心凹的 GA或出现异常的 MNV,可能伴有出血、硬性渗出、视网膜层间积液(intraretinal fluid,IRF)或视网膜下积液(subretinal fluid,SRF)、浆液性或出血性 PED、神经上皮下或色素上皮下纤维血管增生、盘状瘢痕。患者视力受到影响[1] 。
(二)CNV
根据解剖位置,CNV 分为中心凹下型(指病变位于黄斑中心凹无血管区正下方)、中心凹旁型(指病变与黄斑中心凹无灌注区中央的距离<200 μm)和中心凹外型(指病变与黄斑中心凹无灌注区中央
的距离≥200 μm)。
根据 FFA 表现,CNV 分为经典为主型、微小经典型和隐匿型。经典型 CNV在 FFA早期表现为边界清晰的强荧光区域,晚期进行性荧光渗漏。隐匿型CNV包括纤维血管性 PED和不明来源的晚期渗漏(late leakage of undetermined source,LLUS)。其中,纤维血管性 PED 的 FFA 表现为边界不清、不规则的RPE染色或渗漏,病灶表面通常出现混合点状强荧光;LLUS 在 FFA 晚期表现为边界不清的渗漏区域,但在早期和中期无经典型 CNV 或纤维血管性 PED 导致的渗漏。CNV 可兼具经典型和隐匿型表现,属于混合型。经典型表现占病变区域50%及以上,为经典为主型 CNV;经典型表现占病变区域不足50%,为微小经典型CNV;无经典型表现,为隐匿型CNV[61] 。
根据 ICGA 表现对 CNV 进行分类。FFA 表现为经典型CNV的ICGA表现与FFA表现相似。FFA表现为隐匿型的 CNV,根据 ICGA 表现可进一步分类:(1)焦点状 CNV(热点 CNV),指 CNV 强荧光范围直径≤1 视盘直径(diameter of optic disc,DD),且边界清晰;(2)斑片状 CNV,指 CNV 强荧光范围直径>1 DD,荧光强度较焦点状 CNV 弱;(3)混合型CNV,指同时存在焦点状和斑片状CNV[62] 。
(三)MNV
在最新的国际 AMD 命名专家共识中,鉴于AMD 中 特 殊 类 型 视 网 膜 血 管 瘤 样 增 生(retinal angiogmatous proliferation,RAP)的新生血管来源于视网膜,而非脉络膜,使用“CNV”无法准确涵盖AMD 中所有类型的新生血管,建议将既往使用的术语 CNV 更换为 MNV[63] 。MNV 是指新生血管长入黄斑区视网膜、视网膜下腔或RPE下腔。基于新生血管在视网膜组织中的起源和存在部位不同,MNV分为1型、2型和3型。
1.1 型 MNV:起源于脉络膜毛细血管,向 RPE下间隙生长,既往称为隐匿型CNV。随着病灶生长和扩大,脉络膜和病灶内的滋养血管和引流血管发生重塑,逐渐增粗。MNV在成纤维细胞、肌成纤维细胞和巨噬细胞等参与下,可形成纤维组织[6,63] 。而新生血管的渗漏、出血和纤维组织增生又可能导致纤维血管性PED。
PCV是1型MNV的重要亚类,以脉络膜异常分支血管网和分支血管网边缘的结节样血管团块(息肉)为特征性改变[6,63] 。表现为脉络膜血管异常扩张,大量纤维蛋白和血浆渗出,动脉硬化且平滑肌丢失;分支血管网的血管可异常粗大,部分息肉具有搏动性,并易出血。对于息肉是简单的动脉瘤还是更复杂的血管结构,目前尚未达成共识[6] 。PCV通常无玻璃膜疣和色素异常,且较少发展为黄斑萎缩。
2.2型MNV:起源于脉络膜毛细血管,穿过RPE后在视网膜下间隙生长,既往称为经典型CNV。其合并的出血和渗出可直接进入视网膜下腔。2 型MNV 可与其他类型 MNV 同时存在[6,63] 。1‑2 混合型MNV既有1型又有2型MNV。
3.3 型 MNV:既往称为 RAP,异常血管并非起源于脉络膜,可能起源于视网膜深层毛细血管丛,向外层视网膜延伸。血管增生进一步蔓延至RPE,最终可导致 RPE 破裂、RPE下新生血管形成,并可能与更深层血管吻合[6,63]。视网膜内散在斑片状出血和囊样水肿出现于新生血管形成之前。3 型MNV可表现为IRF、SRF、PED和渗出。PED 是因 RPE 下玻璃膜疣样物质、积液、出血和纤维血管组织等导致 RPE 层及其下方的基板与Bruch膜内胶原层分离。根据 RPE与 Bruch膜之间成分不同,PED分为浆液性PED、出血性PED、纤维血管性 PED 和混合性 PED等,其中浆液性PED可发生在非新生血管性 AMD。还有一类特殊的 PED称为玻璃膜疣样 PED,AREDS 小组将其定义为直径>350 μm、边界清楚、由软性玻璃膜疣融合导致的 PED。玻璃膜疣样 PED 是中期 AMD 进展为 GA或新生血管性 AMD 的危险因素。1 型和 3 型 MNV均可出现 PED,1 型 MNV 出现 PED 的原因是 RPE层下新生血管渗漏、出血等,而 3型 MNV 发生 PED的原因尚不明确[6,63] 。
六、AMD的诊断
(一)病史采集
50岁以上初次就诊患者应询问患者主诉和相关病史。AMD的症状包括视力下降、视物变形、视野中心暗点、闪光感、暗适应差等。应询问症状出现的时间、严重程度、视物变形或中心暗点的范围等。应针对 AMD 的危险因素进行仔细询问,包括患者的年龄、性别、种族等基本资料;眼病史;高血压病、糖尿病、动脉硬化等全身疾病史;家族史,尤其 AMD 家族史;个人史,吸烟、饮酒史以及其他简要的社会史;饮食及服用药物情况、营养补充剂的使用情况等。
(二)初步检查
检查裸眼视力、远近最佳矫正视力、眼前节情况。使用检眼镜或裂隙灯显微镜联合前置镜检查眼底,是所有初诊患者必须进行的初步检查,有助于AMD的诊断及分期,以指导后续的检查和治疗。Amsler 方格表是重要、便捷、灵敏的黄斑功能检测工具。对于具有视物变形、中心暗点、视力下降等疑似 AMD 症状的患者,均应进行 Amsler 方格表检查,有助于明确患者视物变形的范围或暗点的相对位置。
(三)眼底照相
眼底照相能够清晰、准确、客观记录AMD患者眼底病变情况,有利于评估疾病程度、病变进展及治疗效果,可作为患者随访和长期管理的重要资料。
(四)FFA和ICGA检查
FFA 既往是诊断和随访 AMD 的唯一检查方法,可判断是否存在 MNV,并评估 MNV 的类型、大小、位置、活动性等。然而,随着OCT、OCTA等无创检查方法广泛应用,造影检查在 AMD 的诊断和随访中部分被替代。但是,在必要时造影检查仍可作为确定诊断、判断疾病类型、评估MNV病灶活动性的有效方法之一。
1 型 MNV 的 FFA 主要表现为边界不清、弥漫、多点状的荧光渗漏(多位于隆起的 RPE 下方),而ICGA 多仅表现为晚期斑块状强荧光,少数可显示部分新生血管结构;PCV 的形态特征则 ICGA 显示最佳,表现为早期异常的分枝状血管网、结节样病灶充盈,晚期荧光渗漏或着染。ICGA 仍是 PCV 诊断的金标准[64] 。2 型 MNV 的 FFA 表现为较早出现的境界清晰的强荧光灶,晚期荧光渗漏。3型MNV的FFA主要表现为囊样水肿区域内的强荧光积存,而ICGA可能发现较小的强荧光病灶[65] 。
检查者须密切关注使用造影剂的潜在风险,如疼痛、组织渗漏、过敏反应等,并准备应对不良反应的应急处理预案,以减少造影剂相关医疗安全事件发生。
(五)OCT检查
OCT 是诊断和随访 AMD 的重要检查方法,无创且便捷,与其他眼科影像学检查相比,其 B 扫描可同时观察视网膜各层切面结构,对于发现 MNV病灶、判断分型及疾病活动性更具优势[66] 。尤其在随访模式下,OCT可精确采集视网膜的结构图像并比较其变化,有助于 AMD 的疗效评估和及时调整治疗方案。新一代扫频 OCT(swept‑source OCT,SS‑OCT),波长为 1 050~1 060 nm,穿透力更强,分辨率更高,检出视网膜和脉络膜结构异常的能力明显提高。
1型 MNV 的 OCT 主要表现为 RPE 层下的中高反射,常伴有纤维血管性或浆液性 PED、SRF、IRF等;PCV的OCT主要表现为脉络膜息肉样病灶呈指状隆起,分枝状血管网呈扁平或波浪样 RPE 隆起、变[64] 。2 型 MNV 的 OCT 主要表现为视网膜下的中MNV即RAP的OCT典型表现为视网膜内高反射条带向深层组织延伸,常伴有PED和IRF[68] 。
(六)OCTA检查
OCTA 是一种新型的眼底影像学检查方法。眼底血管中存在流动的血细胞,对同一横断面进行重复的相干光层析成像后,通过特殊的计算方法,获得移动血细胞即血流信号,并据此重建血管的三维结构,以冠状面形式逐层显示眼底血管影像。OCTA 能够无创评估视网膜和脉络膜血管系统,与传统造影检查方法比较,具有无创、快速、安全、可重复检查等优势,已在 AMD 的诊断和管理中得到较为广泛应用。OCTA 可用于发现、观察和随访新生血管性 AMD 病灶。基于循证医学证据综合分析,OCTA 诊断 MNV 的效力与 FFA 接近(灵敏度为91%,特异度为 73%)[66,69‑73] 。在 PCV 的诊断方面,OCTA 的灵敏度为 79%,特异度为 72%[8,74‑75] ;OCT联合 OCTA 的灵敏度为 84%,特异度为 67%[8,74]。在 RAP的诊断方面,对于 FFA 或 ICGA 发现的病灶区域,OCTA 可观察到对应的异常血流信号[76] 。其他研究结果也显示了 OCTA 对新生血管类病灶具有诊断能力[7,77] 。在分析 OCTA 图像过程中,应避免分层错误、投射伪影等对新生血管识别的干扰。
[推荐意见1]
诊断新生血管性 AMD,相较于 FFA 或 ICGA,有条件推荐OCT联合OCTA作为检查方法(2B)。
[推荐说明]
- 在新生血管性 AMD 的 MNV 病灶诊断方面,OCTA 的灵敏度和特异度与 FFA 或 ICGA 相似,可用于检查新生血管性AMD,以便准确、无创诊断新生血管性 AMD,并减少造影可能引起的不良反应。OCT 的 B 扫描可有效显示 IRF、SRF、PED 等,便于对新生血管性 AMD 活动性进行判断。因此,对于新生血管性 AMD(除外 PCV 和 RAP),建议以 OCT联合OCTA作为检查和诊断方法。
- 在 PCV 诊断方面,ICGA 的灵敏度和特异度均优于 OCTA,ICGA 仍是 PCV 检查和诊断的金标准。
- 在 RAP 诊断方面,尚无充足证据证明 OCTA的灵敏度和特异度优于 FFA 或 ICGA,OCT 仍为RAP的常用检查和诊断方法。
- 初诊时建议常规进行眼底照相、OCT;当OCT发现可疑病灶时(如发现PED或可疑PCV),根据需要进行 FFA、ICGA 或 OCTA 以明确病灶和诊断。若患者全身情况不允许行 FFA 或 ICGA(如磺胺或碘 过 敏 、肝肾功能不全等),可考虑进行OCTA。
七、AMD的治疗
(一)早至中期AMD的治疗
早至中期 AMD 患者视功能尚无明显损伤,治疗目标为防止向进展期 AMD 发展,防止视力明显下降。在防止向进展期 AMD 发展方面,可补充抗氧化维生素(维生素C、维生素E)、矿物质(锌、铜)、叶黄素、玉米黄质等。补充不同抗氧化维生素和矿物质呈现不同的治疗效果。
在一项针对 AMD 患者补充抗氧化维生素和矿物质的大型研究(AREDS)中,受试者每日口服维生素 C(500 mg)、维生素 E(400 IU)、β 胡萝卜素(15 mg)、氧化锌(80 mg)、氧化铜(2 mg,预防锌引起的铜缺乏性贫血)[5] 。在一项针对中期 AMD(双眼存在大玻璃膜疣或 1 只眼存在大玻璃膜疣、对侧眼为进展期 AMD,此类患者具有较高风险发展为进展期 AMD)开展的多中心、随机、双盲、安慰 剂 对 照 的 Ⅲ 期 临 床 试 验(AREDS2)中 ,在AREDS 配方基础上使用叶黄素(10 mg)和玉米黄质(2 mg)取 代 β 胡 萝 卜 素 ,补 充 锌(80 mg或25 mg),增加 Omega‑3 长链不饱和脂肪酸[78]。在现有的多项相关研究中,针对早至中期 AMD 的营养补充剂也多为叶黄素(10 mg 或 20 mg)、玉米黄 质(10 mg)、混 合 维 生 素 和 矿 物 质 、硫 酸 锌(200 mg)、二十二碳六烯酸(docosahexaenoic acid,DHA)(840 mg)和二十碳五烯酸(eicosapentaenoicacid,EPA)(270 mg)等[5,78‑89] 。
[推荐意见2]
基于目前的循证医学证据[5,78‑89] ,建议早至中期AMD补充抗氧化维生素、锌(氧化锌或硫酸锌)、叶黄素、玉米黄质,或者混合型抗氧化维生素和矿物质(2B);抗氧化维生素和矿物质补充需达到一定剂量才可能产生相应获益;不建议补充脂肪酸(B)。
[推荐说明]
针对早至中期 AMD 营养补充剂,采用循证医学方法共检索到 2 632 篇文献,最终纳入系统评价2 项,临床试验 13 项。早期 AMD 治疗研究结果显示,补充叶黄素、玉米黄质可提高黄斑区色素水平和对比敏感度,但是目前尚无证据表明补充抗氧化维生素、矿物质能够阻止早期 AMD 进展为中期或进展期AMD[5,78‑89] 。
基于循证医学证据[5,78‑89] 进行综合分析,发现对于早至中期 AMD,补充抗氧化维生素和矿物质等1年以上,能够降低BCVA丢失10个及以上字母患者的比例;与安慰剂相比,补充叶黄素或叶黄素及玉米黄质者的BCVA略高。与安慰剂相比,补充锌(硫酸锌或氧化锌)1 年以上,发展到进展期AMD、BCVA丢失10个字母以上的风险降低。与安慰剂相比,补充营养复合制剂 1 年以上,发展到进展期 AMD 的风险降低,BCVA 略高,BCVA 丢失15个字母以上的风险降低,生活质量略好。
此外,补充 β 胡萝卜素可能引起皮肤变黄,增加吸烟患者患肺癌的风险。补充锌可能增加因泌尿系统疾病而住院的风险,可能引起铜缺乏性贫血。当考虑长期补充上述营养物质时,须结合患者的全身情况,必要时联合相关专业医师进行综合判断,防止不良反应。
(二)新生血管性AMD的抗VEGF治疗
- 抗 VEGF 药物:抗 VEGF 药物玻璃体腔注射给药能够改善新生血管性 AMD 患者的视功能,恢复黄斑区解剖结构,是累及中心凹或中心凹旁MNV的一线治疗方法。目前我国可用于新生血管性 AMD治疗的抗 VEGF药物包括雷珠单克隆抗体、康柏西普和阿柏西普。
(1)雷珠单克隆抗体:雷珠单克隆抗体眼内注射液是一种重组人源化的单克隆抗体 Fab片段,可靶向抑制 VEGF‑A 的所有亚型。雷珠单克隆抗体是国家药品监督管理局批准的首个抗VEGF药物,于2011年开始用于临床治疗新生血管性AMD。推荐给药方案为每月玻璃体腔注射给药1次(0.5 mg/次),即每月或每 4 周方案;或者初始 3 个月每月玻璃体腔注射给药 1 次(0.5 mg/次),后按需给药(pro re nata,PRN),即3+PRN方案。
一项前瞻性、多中心、双盲、空白对照、采用雷珠单克隆抗体每4周方案(0.3 mg组和0.5 mg组)治疗继发于新生血管性AMD的微小经典型或隐匿型CNV的 2年临床试验(Marina研究)结果显示,与空白对照组比较,平均视力提高 0.3 mg 组为 6.5 个字母,0.5 mg组为7.2个字母,而空白对照组平均视力下降 10.4 个字母[9] 。另一项国际多中心、双盲、随机、采用雷珠单克隆抗体每 4 周方案(0.3 mg 组和0.5 mg 组)与光动力治疗(photodynamics therapy,PDT)(PDT 组)对照,治疗继发于新生血管性 AMD的经典为主型 CNV 的 2 年临床试验(Anchor 研究)结果显示,平均视力提高雷珠单克隆抗体0.3mg组为 8.5个字母,雷珠单克隆抗体 0.5 mg组为11.3 个字母,而PDT组平均视力下降9.5个字母,对于经典为 主 型 CNV,雷 珠 单 克 隆 抗 体 治 疗 效 果 优 于PDT[90] 。基于上述研究结果,2006年雷珠单克隆抗体在美国获准用于新生血管性 AMD 治疗,开启了新生血管性AMD抗VEGF治疗的历程。
(2)康柏西普:康柏西普是我国自主研发的融合蛋白类抗 VEGF 药物,由人 VEGF 受体(VEGF receptor,VEGFR)1 中的 Ig 区域 2 和 VEGFR2 中的Ig区域 3和 4与人 Ig Fc片段融合而成,可同时阻断VEGF‑A、VEGF‑B和PlGF,于2013年获准用于治疗新生血管性 AMD。推荐给药方案为初始 3 个月每月玻璃体腔注射给药 1 次(0.5 mg/次),之后每 3 个月玻璃体腔注射给药 1 次,即 3+每 3 个月方案;或者 在初始3个月每月玻璃体腔注射给药1次(0.5 mg/次)后PRN,即3+PRN方案[91] 。
在一项康柏西普治疗新生血管性 AMD 的随机、双盲、多中心Ⅱ期临床试验(Aurora研究)中,患者随机分为康柏西普 0.5 mg 组(0.5 mg/次)和 2 mg(2 mg/次)组,在初始3个月每月玻璃体腔注射给药1 次后,2 个组内再随机分为每月给药亚组和 PRN亚组,治疗 12 个月后各亚组视力分别较基线平均提高 14.31(0.5 mg 组中 3+PRN 亚组)、9.31(0.5 mg组中 3+每月给药亚组)、12.42(2 mg组中 3+PRN 亚组)、15.43个字母(2 mg组中 3+每月给药亚组),康柏西普治疗新生血管性AMD具有良好的有效性和安全性[92] 。在另一项采用康柏西普(0.5 mg/次)治疗新生血管性AMD的前瞻性、多中心、双盲Ⅲ期临床试验(Phoenix 研究)中,康柏西普采用 3+每 3 个月方案,治疗 12 个月患者的 BCVA 较基线提高9.98个字母,康柏西普采用3+每3个月方案能够有效治疗并改善新生血管性AMD患者的视功能[10] 。
(3)阿柏西普:阿柏西普是全人源化融合蛋白,包含人 VEGFR1 的 Ig 结构域 2、人 VEGFR2 的 Ig 结构域 3 和人 IgG1 的 Fc 区,可同时阻断 VEGF‑A、VEGF‑B 和 PlGF,于 2018 年在我国获准用于临床。针对新生血管性AMD治疗的推荐给药方案为初始3 个月每月玻璃体腔注射给药 1 次(2 mg/次)后每8周玻璃体腔注射给药1次,即3+每8周方案;或者初始 3个月每月玻璃体腔注射给药 1次(2 mg/次),之后采取治疗‑延长给药(treat and extend,T&E),即3+T&E方案。
一项全球范围内观察阿柏西普治疗累及黄斑中心凹的新生血管性AMD有效性和安全性的多中心、随机、对照、双盲Ⅲ期临床试验(View 1 和 2 研究)结果显示,阿柏西普每 4 周方案(0.5 mg/次或2 mg/次)或3+每8周方案(2 mg/次),与雷珠单克隆抗体每 4 周方案(0.5 mg/次)比较,治疗力维持(主要结局指标)作用相当 52 周后视[11] 。在一项中国开展的多中心、随机、对照、双盲Ⅲ期临床试验(Sight 研究)中,分别采用阿柏西普 3+每 8 周方案(2 mg/次)和 PDT 治疗继发于 AMD 的经典为主型CNV共52周,平均视力前者提升15.2个字母,后者提升 8.9 个字母,阿柏西普在改善视力方面的疗效
优于PDT [93] 。
[推荐意见3]
单克隆抗体类或融合蛋白类抗 VEGF 药物均可有效治疗新生血管性AMD。
- 抗 VEGF 治疗方案:抗 VEGF 药物玻璃体腔注射给药是新生血管性 AMD 的一线治疗方法,大量临床试验结果证实抗 VEGF 药物能够有效改善新生血管性 AMD 患者的视功能,但是在临床实践中,由于患者依从性欠佳、给药方案不同、治疗不足等原因,新生血管性 AMD 患者抗 VEGF 治疗后视功能改善情况往往不如临床试验结果。因此,选择合适的抗 VEGF 治疗方案,对于增强患者依从性,提高治疗的可执行性,改善抗 VEGF 治疗效果,维持患者远期视力获益具有重要意义。
以往临床试验中所涉及的抗 VEGF 治疗方案主要包括两大类:(1)固定玻璃体腔注射给药间隔时间,包括每月注射给药1次(每月或每4周)方案;初始 3 个月每月注射给药 1 次后,每 8 周注射给药1 次(3+每 8 周)方案;初始 3 个月每月注射给药1 次后,每 3 个月注射给药 1 次(3+每 3 个月)方案。(2)个体化玻璃体腔注射给药,包括初始 3 个月每月注射给药 1 次后 PRN(3+PRN)方案,初始 3 个月每月注射给药1次后T&E(3+T&E)方案。
3+PRN 方案和 3+T&E 方案均需要评估疾病的活动性。新生血管性AMD疾病活动性的判断是基于患者视功能和黄斑解剖结构变化,如黄斑区新的出血、出现IRF或SRF、患者视力下降5个字母以上等[92,94‑97] 。3+PRN 方案是在疾病再次出现活动性时给予抗 VEGF治疗,而疾病无活动性时仅每月随访观察疾病状态。3+T&E 方案是在每次随访时均给予抗 VEGF治疗,疾病活动性用于决定玻璃体腔注射给药的间隔时间,若疾病无活动性则延长注射给药间隔时间,若疾病出现活动性则缩短注射给药间隔时间。临床试验中 T&E 的注射给药间隔时间多采用每次延长或缩短 2周,直到最长注射给药间隔时间为12周[98] 。部分临床试验中T&E的间隔时间采用每次延长或缩短 4周,可将最长间隔时间延长至16周,以期减轻患者的治疗负担[99] 。
在一项多中心、单盲、随机对照比较雷珠单克隆抗体与贝伐单克隆抗体采用每 4 周方案或3+PRN 方案治疗新生血管性 AMD的临床试验(Catt研究)中,采用雷珠单克隆抗体(0.5 mg/次)按3+PRN方案治疗1年,视力改善程度与雷珠单克隆抗体(0.5 mg/次)每 4 周方案无显著差异(提 高6.8个字母与8.5个字母)[100] 。另一项长达8年的临床试验结果证实,3+PRN 方案能够使 50% 新生血管性 AMD 患者视力稳定或提高[101] 。真实世界研究结果同样证实,3+PRN方案和其他非固定给药方案均可使 50%~60% 新生血管性 AMD 患者的视力保持稳定[102‑104]。
几项前瞻性、多中心、随机对照比较雷珠单克隆抗体每 4 周方案与 3+T&E 方案治疗新生血管性AMD的临床试验(Trex、Trend和Cantreat研究)结果证实,两方案治疗后患者视力获益无显著差异,而后者注射给药次数则显著少于前者[95‑97] 。
康柏西普在其注册的研究中探索了玻璃体腔注射给药固定间隔时间方案和个体化 PRN 方案。在 Phoenix 研究中,采用康柏西普(0.5 mg/次)3+每3 个月方案治疗 12 个月,BCVA 较基线平均提高9.98 个字母,CRT 较基线平均降低 99.63 μm。在Aurora 研究中,康柏西普 0.5 mg 3+PRN 组在治疗12 个月时 BCVA 较基线平均提高 14.31 个字母,CRT 较基线平均降低 119.8 μm。康柏西普 3+每3 个月方案和 3+PRN 方案可有效改善新生血管性AMD患者的视功能,并恢复眼部解剖结构[10,92] 。
在一项使用阿柏西普治疗新生血管性AMD的Ⅳ期临床试验(Altair 研究)中,采用 2 种 3+T&E 方案,即玻璃体腔注射给药间隔时间每次延长或缩短2周(2周组)和玻璃体腔注射给药间隔时间每次延长或缩短 4 周(4 周组),治疗 52 周后发现 2 周组和4 周组患者的视功能和眼部解剖结构均得到明显改善,且效果维持至 96 周。96 周时玻璃体腔注射给药间隔时间 56.9% 和 60.2% 患者可延长至 12 周及以上,41.5%和46.3%患者可延长至16周[99] 。
[推荐意见4]
抗 VEGF 药物玻璃体腔注射给药是新生血管性 AMD 的一线治疗方法。抗 VEGF 药物玻璃体腔注射给药可采用不同方案。根据目前循证医学证据[105‑113],无论是单克隆抗体还是融合蛋白类抗VEGF 药物,与 3+PRN 方案比较,3+T&E 方案具有一定程度获益(2C)。
[推荐说明]
针对比较新生血管性 AMD 抗 VEGF 个性化治疗方案,采用循证医学方法共检索到5 022篇文献,指南共识专家组补充 1篇文献,最终纳入系统评价1项,临床试验9项。基于循证医学证据,综合分析结果显示,与 3+PRN方案比较,3+T&E方案在治疗1和 2年时,BCVA 较基线提高的平均值略高,注射给药次数平均增加 2.79 针(1 年)和 2.8 针(2 年)。3+T&E方案较3+PRN方案注射给药次数多2~3针,注射费用有一定增加,但在长期视力和形态学指标方面可表现出一定程度获益。在新生血管性AMD抗VEGF治疗中,相较于 3+PRN方案,有条件推荐3+T&E方案。鉴于不同抗VEGF药物的推荐玻璃体腔注射给药最长间隔时间不同,采用 3+T&E 方案时须考虑合适的随访间隔时间。
- 新生血管性 AMD 抗 VEGF 药物初始 3 个月每月玻璃体腔注射给药 1 次(负载治疗)后无应答的处理建议:在临床实践中,并非所有新生血管性AMD 对抗 VEGF 治疗反应良好,研究结果显示,30%患者治疗后无应答或疗效欠佳,视功能改善有限[114]。目前,对新生血管性 AMD抗答的定义和分类尚未达成共识[115] 。 VEGF 一般认为 治疗应,积液量(IRF、SRF和CRT)或出血量与基线相比增加,和(或)BCVA与基线或治疗后最高BCVA相比丢失字母数>5个应答[116] 。
[推荐意见5]
对一种抗 VEGF药物的治疗应答不佳,可考虑更换其他抗 VEGF 药物。基于目前的循证医学证据[117‑124] ,更换不同抗 VEGF 药物进行治疗,无明显获益也无明显风险。在临床实践中,针对抗 VEGF三针负载治疗后无应答的新生血管性 AMD,由临床医师综合考虑决定下一步治疗方案(2D)[117]。
[推荐说明]
采用循证医学方法共检索到 5 452 篇文献,最终 纳 入 系 统 评 价 1 项 ,临 床 试 验8项(1项 为RCT[117] 、7项为观察性研究[118‑124] )。其中,RCT结果显示,更换不同抗 VEGF 药物治疗的患者 BCVA 较基线平均降低 2.0 个字母,继续维持原抗 VEGF 药物治疗的患者 BCVA 较基线平均提高 0.5 个字母(B),注射次数无明显差异(C);5项观察性研究结果表明[119‑123] ,更换不同抗 VEGF 药物的患者 BCVA较基线平均增加了0.26个字母(D)。对于抗VEGF三针负载治疗无应答的新生血管性 AMD,更换不同抗VEGF药物后无明显获益,但也无明显风险。
- 新生血管性 AMD 持续性 PED 的处理建议:新生血管性 AMD 多伴有 PED,PED 被认为是新生血管性 AMD 严重程度、疾病进展以及对治疗抵抗的潜在标志。在临床实践中,新生血管性 AMD 抗VEGF 治疗后,SRF、IRF 往往相对易吸收,而 PED的解剖结构改善往往相对有限。对于正在进行抗VEGF治疗的新生血管性AMD,若SRF、IRF等疾病活动性指标得到缓解,但存在持续性 PED,是继续抗 VEGF治疗还是停止治疗观察,是临床医师面临的问题。
[推荐意见6]
关于新生血管性AMD持续性PED目前仅有继续抗 VEGF 治疗的相关证据,在解剖学相关结局(如PED高度)方面有所改善,但不能排除是否为自然病程所致结果,且视力无明显获益(D)。因此,目前证据尚不能解决临床实践中存在的问题,还需要进行高质量研究,暂无法形成推荐意见[125‑131] 。
[推荐说明]
循证医学方法共检索到 5 543 篇文献,指南共识专家组补充 7 篇文献,最终纳入观察性研究7 项[125,127‑132] 。研究结果显示,对于持续性 PED,继续抗 VEGF 治疗1年,PED高度较基线平均降低45.89 μm(D)[125,129‑132],BCVA较基线平均降低 1 个字母(D)[125,129‑130,132]。现有文献中未见关键亚型PCV的相关证据。
- 新生血管性 AMD 非渗出性 MNV 的处理建议:近年来,随着 OCTA 的广泛应用,在 AMD 患者,尤其一只眼为进展期 AMD 患者的对侧眼中,常检测出黄斑区异常的新生血管血流信号,但此时患者尚无明显症状。针对这种 OCTA 发现 MNV 血流信号,但 OCT 显示不伴有积液(SRF 和 IRF)的非渗出性MNV,是否需要立即采用抗VEGF治疗是临床医师面临的问题。
[推荐意见7]
当 OCT 或 OCTA 发现新生血管性 AMD 非渗出性 MNV 时,建议密切观察(2D)。一旦发现新生血管具有活动性,出现积液、渗出或出血等,应及时采用抗VEGF治疗。
[推荐说明]
采用循证医学方法共检索到 934篇文献,指南共识专家组补充 11 篇文献,最终纳入观察性研究6 项[133‑138] 。由新生血管性 AMD 非渗出性 MNV 发展为渗出性MNV的比例在1年内为25%,在2年内为 31%。由此可见,新生血管性 AMD 非渗出性MNV 在短期内发展为渗出性 MNV 且患者出现明显视力下降的风险高,应建议患者注意视力变化并密切随访,一旦 MNV 出现活动性,则应采用抗VEGF治疗[133‑137,139‑145] 。
(三)新生血管性AMD的激光治疗
- 视网膜激光光凝术:对于位于黄斑中心凹外的 MNV,视网膜激光光凝术是可用的治疗方法之一。对于边界清晰的黄斑中心凹外 MNV 病灶,视网膜激光光凝术可防止 2年内严重视力下降,但是约50%患者持续存在MNV病灶或复发。黄斑中心下降 30个字母及以上[146‑147] 。以往采用抗 VEGF 药物治疗新生血管性AMD的临床试验均针对黄斑中心凹下或中心凹旁 MNV,未纳入黄斑中心凹外MNV,因此缺少针对黄斑中心凹外 MNV 抗 VEGF治疗的循证医学证据。目前针对MNV位于黄斑中心凹外的新生血管性AMD,抗VEGF治疗或视网膜激光光凝术均是可采用的治疗方法。
-
2.PDT:既往研究结果证实,对于新生血管性AMD,抗VEGF治疗在改善视力和恢复解剖结构方面优于 PDT[90,93] 。对于新生血管性 AMD 中 PCV 亚型,可考虑行单纯抗VEGF治疗或抗VEGF治疗联合PDT(在患者无禁忌证和PDT可使用的情况下)。单纯抗VEGF治疗可有效改善PCV患者视功能,抗VEGF治 疗 联 合 PDT 可 减 少 抗 VEGF 治 疗 的次数[33,148‑152] 。
八、AMD的随访
(一)检查
调查病史和进行相关影像学检查是AMD随访的主要内容。随访病史应考虑以下几点:(1)症状,如视力下降和视物变形;(2)摄入的药物和营养补充剂;(3)疾病史,尤其眼科疾病史;(4)社会史,如吸烟等[40]。
随访应检查 BCVA,并行 Amsler方格表和眼底镜检查。根据临床发现和医师的判断进行 OCT、OCTA 和 FFA 或 ICGA 等后续检查,有助于检测疾病的活动性并监测疾病的进展。初始治疗和抗VEGF 治疗应约每隔 4周进行 1次随访或根据给药方案决定[9,153] 。告知患者治疗后若出现严重眼痛、眼红或视力下降等,应立即就诊,重新进行检查。
[推荐意见8]
AMD 属于慢性疾病,需要长期观察和随访。鉴于 FFA 和 ICGA 为有创检查,不适宜多次反复使用。对于新生血管性AMD,考虑到OCTA检查在不同级别医院中的可行性可能存在差别,建议使用OCT联合OCTA进行随访观察[7‑8,66,69‑77,154‑155] 。
(二)对侧眼
- 对侧眼无 MNV 病灶:对于一只眼为新生血管性 AMD而对侧眼无 MNV的患者,对侧眼发展为进 展 期 AMD 的 风 险 较 高[156]。服 用AREDS 或AREDS2中的营养补充剂,10年内风险可降低36%[153] 。告知患者即使在无症状的情况下,仍需监测视力并定期随访,在出现任何新的或明显的视觉症状时更应如此。具有极高风险的患者(如一只眼为进展期 AMD,对侧眼存在大量玻璃膜疣)可增加检查频次(每6~12个月1次),以在可治疗阶段发现无症状 MNV。同时,提示患者定期进行自我测试。此外,OCT和OCTA有助于评估高危对侧眼。
- 对侧眼有 MNV 病灶:对于一只眼已发展为进 展 期 AMD 的 患 者 ,若 对 侧 眼 发 现 非 渗 出 性MNV,则对侧眼发展为渗出性 MNV的可能性增大[5,136],尤其在第 1 年内,MNV面积每月可增长20%,更应注意转化为渗出性 MNV[136] 。此外,OCT和 OCTA 检查若发现黄斑区视网膜厚度增加、PED的宽度和高度增加、MNV 面积增大以及有分支模式和病灶旁出现低密度晕,均预示非渗出性 MNV可能向渗出性MNV转变,应密切关注,必要时及时给予治疗,避免视功能发生不可逆性损伤[157] 。
九、总结
本指南是我国第1部严格遵循WHO指南制订规范和国际指南标准制订的基于循证医学证据的AMD诊断和治疗临床实践指南。指南指导委员会和指南共识专家组通过广泛调研和征集意见,确定了与 AMD 诊疗相关的 8个临床关键问题。通过全面的文献检索和研究证据分析,结合患者的价值观和偏好,并充分考虑我国的国情和基层卫生医疗资源的可及性,最终形成针对 AMD 诊断和治疗的推荐意见,并对推荐意见进行了详细的解释和说明。本指南更新了对 AMD 病理生理及分型等的认识,涵盖了眼底影像学、治疗药物及其给药方案方面的最新进展,对于我国AMD的诊断、治疗和预防具有重要的指导意义。同时,指南工作组提示,眼科及相关领域的临床医师在使用本指南时,应接受相关培训,并结合当地的医疗条件和患者个体化因素具体分析和综合判断。
本指南由中华医学会眼科学分会眼底病学组、中国医师协会眼科医师分会眼底病学组与国家眼部疾病临床医学研究中心共同承担制订工作,由指南工作组分工完成。欢迎对本指南存在的不足提出宝贵的建议和意见,使得本指南能够不断更新和完善。
形成指南意见的专家组成员:(# 示中华医学会眼科学分会眼底病学组委员,*示中国医师协会眼科医师分会眼底病学组委员)
指南指导委员会首席临床专家:许迅#*(上海交通大学医学院附属第一人民医院眼科,中华医学会眼科学分会眼底病学组组长,中国医师协会眼科医师分会眼底病学组组长)、黎晓新(北京大学人民医院眼科,现在厦门大学厦门眼科中心,中华医学会眼科学分会眼底病学组前任组长)首席方法学专家:夏君(宁波诺丁汉GRADE中心)刘堃*(上海交通大学医学院附属第一人民医院眼科,执笔)
指南共识专家组(按姓氏拼音排序)
陈有信#*(中国医学科学院北京协和医学院北京协和医院眼科)、戴虹#*(北京医院眼科)、刘堃*(上海交通大学医学院附属第一人民医院眼科)、吕林#*(中山大学中山眼科中心)、苏冠方#*(吉林大学第二医院眼科医院)、孙晓东#*(上海交通大学医学院附属第一人民医院眼科)、唐罗生#*(中南大学湘雅二院眼科)、王雨生#*(解放军空军军医大学西京医院眼科)、魏文斌#*(首都医科大学附属北京同仁医院北京同仁眼科中心)、夏君(宁波诺丁汉GRADE中心)、徐格致#*(复旦大学附属眼耳鼻喉科医院眼科)、杨培增(重庆医科大学附属第一医院眼科)、赵明威#*(北京大学人民医院眼科)、赵培泉#*(上海交通大学医学院附属新华医院眼科)
指南外审专家组(按姓氏拼音排序)
常青*(复旦大学附属眼耳鼻喉科医院眼科)、陈蕾#(中国医科大学附属第一医院眼科)、陈松#*(天津眼科医院)、陈伟奇*(汕头大学·香港中文大学联合汕头国际眼科中心)、陈晓隆#*(中国医科大学盛京医院眼科)、崔彦#(山东大学齐鲁医院眼科)、方肖云#(浙江大学医学院附属第二医院眼科中心)、贺涛#(武汉大学人民医院眼科)、黄厚斌(解放军总医院眼科医学部)、姜春晖*(复旦大学眼耳鼻喉科医院眼科)、蒋沁*(南京医科大学眼科医院)、柯根杰#(安徽省立医院眼科)、李燕#*(昆明医科大学第一附属医院眼科)、李秋明#(郑州大学第一附属医院眼科)、李甦雁#(徐州市第一人民医院眼科)、李筱荣*(天津医科大学眼科医院)、梁建宏*(北京大学人民医院眼科)、梁小玲#(中山大学中山眼科中心海南眼科医院)、刘静#(中国中医科学院望京医院眼科)、刘武*(首都医科大学附属北京同仁医院北京同仁眼科中心)、刘勇#(解放军陆军军医大学第一附属医院眼科)、刘庆淮*(南京医科大学第一附属医院眼科)、刘铁城#(解放军总医院眼科医学部)、刘晓玲*(温州医科大学附属眼视光医院)、刘早霞*(吉林大学第二医院眼科中心)、柳林*(上海交通大学医学院附属仁济医院眼科)、陆方*(四川大学华西医院眼科)、马翔#*(大连医科大学附属第一医院眼科)、曲进锋*(北京大学人民医院眼科)、佘海澄*(首都医科大学附属北京同仁医院北京同仁眼科中心)、沈丽君#*(温州医科大学附属眼视光医院)、沈玺*(上海交通大学医学院附属瑞金医院眼科)、宋艳萍#*(解放军中部战区总医院眼科)、宋宗明#(河南省立眼科医院)、孙大卫#(哈尔滨医科大学附属第二医院眼科)、孙旭芳*(华中科技大学同济医学院附属同济医院眼科)、万光明*(郑州大学第一附属医院眼科)、王方*(同济大学附属第十人民医院眼科)、王鲜#(贵州医科大学附属医院眼科)、王兴荣#(山东中医药大学附属眼科医院)、王艳玲*(首都医科大学附属北京友谊医院眼科)、魏勇*(温州医科大学附属眼视光医院)、文峰*(中山大学中山眼科中心)、肖云*(解放军第四七四医院眼科)、徐国兴#(福建医科大学附属第一医院眼科)、徐海峰#*(山东第一医科大学附属眼科研究所)、俞素勤*(上海交通大学医学院附属第一人民医院眼科)、喻晓兵*(北京医院眼科)、于旭辉#(哈尔滨医科大学附属第一医院眼科)、袁容娣#(解放军陆军军医大学第二附属医院眼科)、张风*(首都医科大学附属北京同仁医院北京同仁眼科中心)、张明#*(四川大学华西医院眼科)、张国明*(深圳市眼科医院)、张红兵*(西北大学第一附 属 医 院 眼 科)、张 美 霞* (四 川 大 学 华 西 医 院 眼 科)、张少冲*(深圳市眼科医院)、张喜梅*(山西省眼科医院)、张新媛#(首都医科大学附属北京同仁医院北京同仁眼科中心)、张学东#(重庆医科大学第一附属医院眼科)、赵博军*(山东第一医科大学附属省立医院眼科)、周琼*(南昌大学第一附属医院眼科)、朱丹#(内蒙古医科大学附属医院眼科)
指南学术秘书组
苏莉(上海交通大学医学院附属第一人民医院眼科,辅助执笔)、陈翀(上海交通大学医学院附属第一人民医院眼科)、杨晓璐(上海交通大学医学院附属第一人民医院眼科)、沈胤忱(上海交通大学医学院附属第一人民医院眼科)
指南证据评价组
齐方(上海道田循证科技有限公司)、苏莉(上海交通大学医学院附属第一人民医院眼科)、陈翀(上海交通大学医学院附属第一人民医院眼科,辅助执笔)、杨晓璐(上海交通大学医学院附属第一人民医院眼科)、沈胤忱(上海交通大学医学院附属第一人民医院眼科)、张阳(上海道田循证科技有限公司)、刘昭远(上海道田循证科技有限公司)、张文洁(上海道田循证科技有限公司)
声明 本指南严格按照世界卫生组织、中华医学会的指南制订规范制订,并参考指南研究与评价工具和国际实践指南报告标准,旨在为临床医疗服务提供指导,不是在各种情况下均必须遵循的医疗标准,也不是为个别特殊个人提供的保健措施;制订过程中严格成员均填写利益冲突声明表,经过评价均与指南制订不存在直接
利益冲突
参 考 文 献
[1] Flaxel CJ, Adelman RA, Bailey ST, et al. Age‑related macular degeneration preferred practice pattern®[J]. Ophthalmology, 2020, 127(1): P1‑P65. DOI: 10.1016/j. ophtha.2019.09.024.
[2] Wong WL, Su X, Li X, et al. Global prevalence of age‑related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta‑analysis[J]. Lancet Glob Health, 2014, 2(2): e106‑e116. DOI: 10.1016/S2214‑109X(13)70145‑1.
[3] Ye H, Zhang Q, Liu X, et al. Prevalence of age‑related macular degeneration in an elderly urban chinese population in China: the Jiangning eye study[J]. Invest Ophthalmol Vis Sci, 2014, 55(10): 6374‑6380. DOI: 10.1167/iovs.14‑14899.
[4] Ferris FL 3rd, Wilkinson CP, Bird A, et al. Clinical classification of age‑related macular degeneration[J]. Ophthalmology, 2013, 120(4): 844‑851. DOI: 10.1016/j. ophtha.2012.10.036.
[5] Age‑Related Eye Disease Study Research Group. A randomized, placebo‑controlled, clinical trial of high‑dose supplementation with vitamins C and E, beta carotene, and zinc for age‑related macular degeneration and vision loss: AREDS report no. 8[J]. Arch Ophthalmol, 2001, 119(10): 1417‑1436. DOI: 10.1001/archopht.119.10.1417.
[6] Spaide RF, Jaffe GJ, Sarraf D, et al. Consensus nomenclature for reporting neovascular age‑related macular degeneration data: consensus on neovascular age‑related macular degeneration nomenclature study group[J]. Ophthalmology, 2020, 127(5): 616‑636. DOI: 10.1016/j.ophtha.2019.11.004.
[7] Miere A, Querques G, Semoun O, et al. Optical coherence tomography angiography in early type 3 neovascularization[J]. Retina, 2015, 35(11): 2236‑2241. DOI: 10.1097/IAE.0000000000000834.
[8] Cheung C, Yanagi Y, Akiba M, et al. Improved detection and diagnosis of polypoidal choroidal vasculopathy using a combination of optical coherence tomography and optical coherence tomography angiography[J]. Retina, 2019, 39(9): 1655‑1663. DOI: 10.1097/IAE.0000000000002228.
[9] Rosenfeld PJ, Brown DM, Heier JS, et al. Ranibizumab for neovascular age‑related macular degeneration[J]. N Engl J Med, 2006, 355(14): 1419‑1431. DOI: 10.1056/
[10] Liu K, Song Y, Xu G, et al. Conbercept for treatment of neovascular age‑related macular degeneration: results of the randomized phase 3 PHOENIX study[J]. Am J Ophthalmol, 2019, 197: 156‑167. DOI: 10.1016/j. ajo.2018.08.026.
[11] Schmidt‑Erfurth U, Kaiser PK, Korobelnik JF, et al. Intravitreal aflibercept injection for neovascular age‑related macular degeneration: ninety‑six‑week results of the VIEW studies[J]. Ophthalmology, 2014, 121(1): 193‑201. DOI: 10.1016/j.ophtha.2013.08.011.
[12] 中华医学会眼科学分会眼底病学组中国老年性黄斑变性临床指南与临床路径制订委员会. 中国老年性黄斑变性临床诊断治疗路径 [J]. 中华眼底病杂志 , 2013, 29(4):343‑355. DOI: 10.3760/cma.j.issn.1005‑1015.2013.04.002.
[13] Alonso‑Coello P, Oxman AD, Moberg J, et al. GRADE evidence to decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: clinical practice guidelines[J]. BMJ, 2016, 353: i2089. DOI: 10.1136/bmj.i2089.
[14] Alonso‑Coello P, Schünemann HJ, Moberg J, et al. GRADE evidence to decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: introduction[J]. BMJ, 2016, 353: i2016. DOI: 10.1136/bmj.i2016.
[15] Guyatt GH, Oxman AD, Kunz R, et al. GRADE guidelines: 7. rating the quality of evidence‑‑inconsistency[J]. J Clin Epidemiol, 2011, 64(12): 1294‑1302. DOI: 10.1016/j. jclinepi.2011.03.017.
[16] Schünemann HJ, Mustafa R, Brozek J, et al. GRADE Guidelines: 16. GRADE evidence to decision frameworks for tests in clinical practice and public health[J]. J Clin Epidemiol, 2016, 76: 89‑98. DOI: 10.1016/j. jclinepi. 2016.01.032.
[17] Committee on Standards for Developing Tr, Institute Of Medicine, Robin G. Clinical practice guidelines we can trust[M]. Washington (DC): National Academies Press (US), 2011.
[18] 蒋朱明, 詹思延, 贾晓巍, 等 . 制订/修订《临床诊疗指南》的基本方法及程序[J]. 中华医学杂志, 2016, 96(4): 250‑253.DOI: 10.3760/cma.j.issn.0376‑2491.2016.04.004.
[19] Stewart LA, Tierney JF, Clarke M. Cochrane handbook for systematic reviews of interventions[M]. Boston: ScienceOpen, Inc., 2011.
[20] Stang A. Critical evaluation of the Newcastle‑ottawa scale for the assessment of the quality of nonrandomized studies in meta‑analyses[J]. Eur J Epidemiol, 2010, 25(9): 603‑605. DOI: 10.1007/s10654‑010‑9491‑z.
[21] Song P, Du Y, Chan KY, et al. The national and subnational prevalence and burden of age‑related macular degeneration in China[J]. J Glob Health, 2017, 7(2): 020703. DOI: 10.7189/jogh.07.020703.
[22] GBD 2019 Blindness and Vision Impairment Collaborators, Vision Loss Expert Group of the Global Burden of Disease Study. Causes of blindness and vision impairment in 2020 and trends over 30 years, and prevalence of avoidable blindness in relation to VISION 2020: the right to sight: an analysis for the global burden of disease study[J]. Lancet Glob Health, 2021, 9(2): e144‑e160. DOI: 10.1016/S2214‑109X(20)30489‑7.
[23] Xu T, Wang B, Liu H, et al. Prevalence and causes of vision loss in China from 1990 to 2019: findings from the global burden of disease study 2019[J]. Lancet Public Health, 2020, 5(12): e682‑e691. DOI: 10.1016/S2468‑2667(20) 30254‑1.
[24] Mitchell P, Liew G, Gopinath B, et al. Age‑related macular degeneration[J]. Lancet, 2018, 392(10153): 1147‑1159. DOI: 10.1016/S0140‑6736(18)31550‑2.
[25] Klein R, Klein BE, Linton KL. Prevalence of age‑related maculopathy. The Beaver Dam eye study[J]. Ophthalmology, 1992, 99(6): 933‑943. DOI: 10.1016/ s0161‑6420(92)31871‑8.
[26] Mitchell P, Smith W, Attebo K, et al. Prevalence of age‑related maculopathy in Australia: the blue mountains eye study[J]. Ophthalmology, 1995, 102(10): 1450‑1460. DOI: 10.1016/s0161‑6420(95)30846‑9.
[27] Colijn JM, Buitendijk G, Prokofyeva E, et al. Prevalence of age‑related macular degeneration in Europe: the past and the future[J]. Ophthalmology, 2017, 124(12): 1753‑1763. DOI: 10.1016/j.ophtha.2017.05.035.
[28] Klein R, Klein BE, Knudtson MD, et al. Prevalence of age‑related macular degeneration in 4 racial/ethnic groups in the multi‑ethnic study of atherosclerosis[J]. Ophthalmology, 2006, 113(3): 373‑380. DOI: 10.1016/j. ophtha.2005.12.013.
[29] Kawasaki R, Yasuda M, Song SJ, et al. The prevalence of age‑related macular degeneration in Asians: a systematic review and meta‑analysis[J]. Ophthalmology, 2010, 117(5): 921‑927. DOI: 10.1016/j.ophtha.2009.10.007.
[30] Sho K, Takahashi K, Yamada H, et al. Polypoidal choroidal vasculopathy: incidence, demographic features, and clinical characteristics[J]. Arch Ophthalmol, 2003, 121(10): 1392‑1396. DOI: 10.1001/archopht.121.10.1392.
[31] Li Y, You QS, Wei WB, et al. Polypoidal choroidal vasculopathy in adult chinese: the Beijing eye study[J]. Ophthalmology, 2014, 121(11): 2290‑2291. DOI: 10.1016/j.ophtha.2014.06.016.
[32] Li X, Zhu Q, Egger A, et al. Two different treatment regimens of ranibizumab 0.5 mg for neovascular age‑related macular degeneration with or without polypoidal choroidal vasculopathy in Chinese patients: results from the phase Ⅳ , randomized , dragon study [J Acta Ophthalmol, 2021, ]. 99( 3): e336‑e 345 . DOI: 10. 1111 / aos.14588.
[33] Qu J, Cheng Y, Li X, et al. Efficacy of intravitreal injection of Conbercept in polypoidal choroidal vasculopathy: subgroup analysis of the aurora study[J]. Retina, 2016, 36(5): 926‑937. DOI: 10.1097/IAE.0000000000000875.
[34] National Institute for Health and Care Excellence. Age‑related macular degeneration: diagnosis and management[M]. London: National Institute for Health and Care Excellence, 2018.
[35] Klein RJ, Zeiss C, Chew EY, et al. Complement factor H polymorphism in age‑related macular degeneration[J]. Science, 2005, 308(5720): 385‑389. DOI: 10.1126/ science.1109557.
[36] Zareparsi S, Branham KE, Li M, et al. Strong association of the Y402H variant in complement factor H at 1q32 with susceptibility to age‑related macular degeneration[J]. Am J Hum Genet, 2005, 77(1): 149‑153. DOI: 10.1086/
[37] Yang Z, Camp NJ, Sun H, et al. A variant of the HTRA1 gene increases susceptibility to age‑related macular degeneration[J]. Science, 2006, 314(5801): 992‑993. DOI: 10.1126/science.1133811.
[38] Kanda A, Chen W, Othman M, et al. A variant of mitochondrial protein LOC387715/ARMS2, not HTRA1, is strongly associated with age‑related macular degeneration[J]. Proc Natl Acad Sci USA, 2007, 104(41): 16227‑16232. DOI: 10.1073/pnas.0703933104.
[39] Francis PJ, Klein ML. Update on the role of genetics in the onset of age‑related macular degeneration[J]. Clin Ophthalmol, 2011, 5: 1127‑1133. DOI: 10.2147/OPTH.
[40] Khan JC, Thurlby DA, Shahid H, et al. Smoking and age related macular degeneration: the number of pack years of cigarette smoking is a major determinant of risk for both geographic atrophy and choroidal neovascularisation[J]. Br J Ophthalmol, 2006, 90(1): 75‑80. DOI: 10.1136/bjo.2005.073643.
[41] Age‑Related Eye Disease Study Research Group. Risk factors associated with age‑related macular degeneration. a case‑control study in the age‑related eye disease study: age‑related eye disease study report number 3[J]. Ophthalmology, 2000, 107(12): 2224‑2232. DOI: 10.1016/s0161‑6420(00)00409‑7.
[42] Hyman L, Schachat AP, He Q, et al. Hypertension, cardiovascular disease, and age‑related macular degeneration: age‑related macular degeneration risk factors study group[J]. Arch Ophthalmol, 2000, 118(3): 351‑358. DOI: 10.1001/archopht.118.3.351.
[43] Klein R, Deng Y, Klein BE, et al. Cardiovascular disease, its risk factors and treatment, and age‑related macular degeneration: women′s health initiative sight exam ancillary study[J]. Am J Ophthalmol, 2007, 143(3): 473‑483. DOI: 10.1016/j.ajo.2006.11.058.
[44] Sangiovanni JP, Agrón E, Meleth AD, et al. Omega‑3 Long‑chain polyunsaturated fatty acid intake and 12‑y incidence of neovascular age‑related macular degeneration and central geographic atrophy: AREDS report 30, a prospective cohort study from the age‑related eye disease study[J]. Am J Clin Nutr, 2009, 90(6): 1601‑1607. DOI: 10.3945/ajcn.2009.27594.
[45] Chong EW, Kreis AJ, Wong TY, et al. Dietary omega‑3 fatty acid and fish intake in the primary prevention of age‑related macular degeneration: a systematic review and meta‑analysis[J]. Arch Ophthalmol, 2008, 126(6): 826‑833. DOI: 10.1001/archopht.126.6.826.
[46] Clemons TE, Milton RC, Klein R, et al. Risk factors for the incidence of advanced age‑related macular degeneration in the age‑related eye disease study (AREDS) AREDS report no. 19[J]. Ophthalmology, 2005, 112(4): 533‑539. DOI: 10.1016/j.ophtha.2004.10.047.
[47] Hogg RE, Woodside JV, McGrath A, et al. Mediterranean diet score and its association with age‑related macular degeneration: the European eye study[J]. Ophthalmology, 2017, 124(1): 82‑89. DOI: 10.1016/j.ophtha.2016.09.019.
[48] Merle B, Colijn JM, Cougnard‑Grégoire A, et al. Mediterranean diet and incidence of advanced age‑related macular degeneration: the eye‑risk consortium[J]. Ophthalmology, 2019, 126(3): 381‑390. DOI: 10.1016/j.ophtha.2018.08.006.
[49] Green WR, Enger C. Age‑related macular degeneration histopathologic studies: the 1992 Lorenz E. Zimmerman lecture[J]. Ophthalmology, 1993, 100(10): 1519‑1535. DOI: 10.1016/s0161‑6420(93)31466‑1.
[50] Sarks S, Cherepanoff S, Killingsworth M, et al. Relationship of basal laminar deposit and membranous debris to the clinical presentation of early age‑related macular degeneration[J]. Invest Ophthalmol Vis Sci, 2007, 48(3): 968‑977. DOI: 10.1167/iovs.06‑0443.
[51] Khan KN, Mahroo OA, Khan RS, et al. Differentiating drusen: drusen and drusen‑like appearances associated with ageing, age‑related macular degeneration, inherited eye disease and other pathological processes[J]. Prog Retin Eye Res, 2016, 53: 70‑106. DOI: 10.1016/j. preteyeres.2016.04.008.
[52] Coleman HR, Chan CC, Ferris FL 3rd, et al. Age‑related macular degeneration[J]. Lancet, 2008, 372(9652): 1835‑1845. DOI: 10.1016/S0140‑6736(08)61759‑6.
[53] Zhou Q, Daniel E, Maguire MG, et al. Pseudodrusen and incidence of late age‑related macular degeneration in fellow eyes in the comparison of age‑related macular degeneration treatments trials[J]. Ophthalmology, 2016, 123(7): 1530‑1540. DOI: 10.1016/j.ophtha.2016.02.043.
[54] van Lookeren Campagne M, LeCouter J, Yaspan BL, et al. Mechanisms of age‑related macular degeneration and therapeutic opportunities[J]. J Pathol, 2014, 232(2): 151‑164. DOI: 10.1002/path.4266.
[55] Keenan TD, Agrón E, Domalpally A, et al. Progression of geographic atrophy in age‑related macular degeneration: AREDS2 report number 16[J]. Ophthalmology, 2018, 125(12): 1913‑1928. DOI: 10.1016/j.ophtha.2018.05.028.
[56] Colijn JM, Liefers B, Joachim N, et al. Enlargement of geographic atrophy from first diagnosis to end of life[J]. JAMA Ophthalmol, 2021, 139(7): 743‑750. DOI: 10.1001/ jamaophthalmol.2021.1407.
[57] Shen LL, Liu F, Grossetta Nardini HK, et al. Fellow eye status is a biomarker for the progression rate of geographic atrophy: a systematic review and meta‑analysis[J]. Ophthalmol Retina, 2019, 3(4): 305‑315. DOI: 10.1016/j.oret.2018.11.013.
[58] Deng Y, Qiao L, Du M, et al. Age‑related macular degeneration: epidemiology, genetics, pathophysiology, diagnosis, and targeted therapy[J]. Genes Dis, 2022, 9(1): 62‑79. DOI: 10.1016/j.gendis.2021.02.009.
[59] Nowak JZ. Age‑related macular degeneration (AMD): pathogenesis and therapy[J]. Pharmacol Rep, 2006, 58(3): 353‑363.
[60] Keenan T, Cukras CA, Chew EY. Age‑related macular degeneration: epidemiology and clinical aspects[J]. Adv Exp Med Biol, 2021, 1256: 1‑31. DOI: 10.1007/ 978‑3‑030‑66014‑7_1.
[61] Occult choroidal neovascularization. Influence on visualoutcome in patients with age‑related maculardegeneration. Macular photocoagulation study group[J]. Arch Ophthalmol, 1996, 114(4): 400‑412.
[62] Guyer DR, Yannuzzi LA, Slakter JS, et al. Classification of choroidal neovascularization by digital indocyanine green videoangiography[J]. Ophthalmology, 1996, 103(12): 2054‑2060. DOI: 10.1016/s0161‑6420(96)30388‑6.
[63] 杨依柳,杨婷婷,陆方,等.新生血管性老年性黄斑变性亚型 报告的国际新命名专家共识解读[J].中华眼底病杂志, 2022, 38(2): 99‑107. DOI: 10.3760/cma.j.cn511434‑20220128‑00055.
[64] Cheung C, Lai T, Ruamviboonsuk P, et al. Polypoidal choroidal vasculopathy: definition, pathogenesis, diagnosis, and management[J]. Ophthalmology, 2018, 125(5): 708‑724. DOI: 10.1016/j.ophtha.2017.11.019.
[65] Holz FG, Sadda SR, Staurenghi G, et al. Imaging protocols in clinical studies in advanced age‑related macular degeneration: recommendations from classification of atrophy consensus meetings[J]. Ophthalmology, 2017, 124(4): 464‑478. DOI: 10.1016/j.ophtha.2016.12.002.
[66] Gong J, Yu S, Gong Y, et al. The diagnostic accuracy of optical coherence tomography angiography for neovascular age‑related macular degeneration: a comparison with fundus fluorescein angiography[J]. J Ophthalmol, 2016, 2016: 7521478. DOI: 10.1155/2016/
[67] Zhao Z, Yang F, Gong Y, et al. The comparison of morphologic characteristics of type 1 and type 2 choroidal neovascularization in eyes with neovascular age‑related macular degeneration using optical coherence tomography angiography[J]. Ophthalmologica, 2019, 242(3): 178‑186. DOI: 10.1159/000497491.
[68] Yannuzzi LA, Freund KB, Takahashi BS. Review of retinal angiomatous proliferation or type 3 neovascularization [J]. Retina, 2008, 28(3): 375‑384. DOI: 10.1097/ IAE.0b013e3181619c55.
[69] Told R. Indocyanine green angiography (ICGA) and OCTA imaging for detecting choroidal neovascularization (CNV) and CNV area (CNV‑A) in patients with type 1 and type 2 nAMD[C]. 2017 ARVO Annual Meeting, Baltimore, MD, 2017. Baltimore: Association for Research in Vision and Ophthalmology, 2017.
[70] Nikolopoulou E, Lorusso M, Micelli Ferrari L, et al. Optical coherence tomography angiography versus dye angiography in age‑related macular degeneration: sensitivity and specificity analysis[J]. Biomed Res Int, 2018, 2018: 6724818. DOI: 10.1155/2018/6724818.
[71] Soomro T, Talks J. The use of optical coherence tomography angiography for detecting choroidal neovascularization, compared to standard multimodal imaging[J]. Eye (Lond), 2018, 32(4): 661‑672. DOI: 10.1038/eye.2018.2.
[72] Usman M, Iqbal K, Ali MH, et al. Features and diagnostic accuracy of optical coherence tomography angiography in neovascular age‑related macular degeneration[J]. Cureus, 2019, 11(12): e6485. DOI: 10.7759/cureus.6485.
[73] Ghanchi FD, Fulcher C, Madanat Z, et al. Optical coherence tomography angiography for identifying choroidal neovascular membranes: a masked study in clinical practice[J]. Eye (Lond), 2021, 35(1): 134‑141. DOI: 10.1038/s41433‑020‑01285‑0.
[74] de Carlo TE, Kokame GT, Kaneko KN, et al. Sensitivity and specificity of detecting polypoidal choroidal vasculopathy with en face optical coherence tomography and optical coherence tomography angiography[J]. Retina, 2019, 39(7): 1343‑1352. DOI: 10.1097/IAE.0000000000002139.
[75] Huang YM, Hsieh MH, Li AF, et al. Sensitivity, specificity, and limitations of optical coherence tomography angiography in diagnosis of polypoidal choroidal vasculopathy[J]. J Ophthalmol, 2017, 2017: 3479695. DOI: 10.1155/2017/3479695.
[76] Mao J, Cheng D, Lin J, et al. Evaluating retinal angiomatous proliferation with optical coherence tomography angiography[J]. Ophthalmic Surg Lasers Imaging Retina, 2020, 51(3): 136‑144. DOI: 10.3928/23258160‑20200228‑02.
[77] Dansingani KK, Naysan J, Freund KB. En face OCT angiography demonstrates flow in early type 3 neovascularization (retinal angiomatous proliferation)[J]. Eye (Lond), 2015, 29(5): 703‑706. DOI: 10.1038/ eye.2015.27.
[78] Age‑Related Eye Disease Study 2 Research Group. Lutein+ zeaxanthin and omega‑3 fatty acids for age‑related macular degeneration: the age‑related eye disease study 2 (AREDS2) randomized clinical trial[J]. JAMA, 2013, 309(19): 2005‑2015. DOI: 10.1001/jama.2013.4997.
[79] Newsome DA, Swartz M, Leone NC, et al. Oral zinc in macular degeneration[J]. Arch Ophthalmol, 1988, 106(2): 192‑198. DOI: 10.1001/archopht.1988.01060130202026.
[80] Stur M, Tittl M, Reitner A, et al. Oral zinc and the second eye in age‑related macular degeneration[J]. Invest Ophthalmol Vis Sci, 1996, 37(7): 1225‑1235.
[81] 李婵, 任伟, 隋永杰. 叶黄素干预对早期年龄相关性黄斑变 性患者视功能的影响[J]. 国际眼科杂志, 2017, 17(11): 2109‑2111. DOI: 10.3980/j.issn.1672‑5123.2017.11.28.
[82] Richer S, Stiles W, Statkute L, et al. Double‑masked, placebo‑controlled, randomized trial of lutein and antioxidant supplementation in the intervention of atrophic age‑related macular degeneration: the veterans last study (lutein antioxidant supplementation trial) [J]. Optometry, 2004, 75(4): 216‑230. DOI: 10.1016/ s1529‑1839(04)70049‑4.
[83] Ma L, Yan SF, Huang YM, et al. Effect of lutein and zeaxanthin on macular pigment and visual function in patients with early age‑related macular degeneration[J]. Ophthalmology, 2012, 119(11): 2290‑2297. DOI: 10.1016/j.ophtha.2012.06.014.
[84] Piermarocchi S, Saviano S, Parisi V, et al. Carotenoids in age‑related maculopathy Italian study (CARMIS): two‑year results of a randomized study[J]. Eur J Ophthalmol, 2012, 22(2): 216‑225. DOI: 10.5301/ ejo.5000069.
[85] Beatty S, Chakravarthy U, Nolan JM, et al. Secondary outcomes in a clinical trial of carotenoids with coantioxidants versus placebo in early age‑related macular degeneration[J]. Ophthalmology, 2013, 120(3): 600‑606. DOI: 10.1016/j.ophtha.2012.08.040.
[86] Murray IJ, Makridaki M, van der Veen RL, et al. Lutein supplementation over a one‑year period in early AMD might have a mild beneficial effect on visual acuity: the clear study[J]. Invest Ophthalmol Vis Sci, 2013, 54(3): 1781‑1788. DOI: 10.1167/iovs.12‑10715.
[87] Souied EH, Delcourt C, Querques G, et al. Oral docosahexaenoic acid in the prevention of exudative age‑related macular degeneration: the nutritional AMD treatment 2 study[J]. Ophthalmology, 2013, 120(8): 1619‑1631. DOI: 10.1016/j.ophtha.2013.01.005.
[88] Huang YM, Dou HL, Huang FF, et al. Changes following supplementation with lutein and zeaxanthin in retinal function in eyes with early age‑related macular degeneration: a randomised, double‑blind, placebo‑controlled trial[J]. Br J Ophthalmol, 2015, 99(3): 371‑375. DOI: 10.1136/ bjophthalmol‑2014‑305503.
[89] Piatti A, Croce A, Mazzacane D, et al. Effect of 2‑year nutritional supplementation on progression of age‑related macular degeneration[J]. Eur J Ophthalmol, 2020, 30(2): 376‑381. DOI: 10.1177/1120672119836007.
[90] Brown DM, Kaiser PK, Michels M, et al. Ranibizumab versus verteporfin for neovascular age‑related macular degeneration[J]. N Engl J Med, 2006, 355(14): 1432‑1444. DOI: 10.1056/NEJMoa062655.
[91] Lu X, Sun X. Profile of conbercept in the treatment of neovascular age‑related macular degeneration[J]. Drug Des Devel Ther, 2015, 9: 2311‑2320. DOI: 10.2147/DDDT.
[92] Li X, Xu G, Wang Y, et al. Safety and efficacy of conbercept in neovascular age‑related macular degeneration: results from a 12‑month randomized phase 2 study: AURORA study[J]. Ophthalmology, 2014, 121(9): 1740‑1747. DOI: 10.1016/j.ophtha.2014.03.026.
[93] Li X, Chen Y, Zhang J, et al. Intravitreal aflibercept versus photodynamic therapy in Chinese patients with neovascular age‑related macular degeneration: outcomes of the SIGHT Study[J]. J Ocul Pharmacol Ther, 2017, 33(6): 435‑444. DOI: 10.1089/jop.2016.0071.
[94] Gillies MC, Hunyor AP, Arnold JJ, et al. Effect of ranibizumab and aflibercept on best‑corrected visual acuity in treat‑and‑extend for neovascular age‑related macular degeneration: a randomized clinical Trial[J]. JAMA Ophthalmol, 2019, 137(4): 372‑379. DOI: 10.1001/ jamaophthalmol.2018.6776.
[95] Wykoff CC, Ou WC, Brown DM, et al. Randomized trial of treat‑and‑extend versus monthly dosing for neovascular age‑related macular degeneration: 2‑year results of the TREX‑AMD study[J]. Ophthalmol Retina, 2017, 1(4): 314‑321. DOI: 10.1016/j.oret.2016.12.004.
[96] Silva R, Berta A, Larsen M, et al. Treat‑and‑extend versus monthly regimen in neovascular age‑related macular degeneration: results with ranibizumab from the TREND study[J]. Ophthalmology, 2018, 125(1): 57‑65. DOI: 10.1016/j.ophtha.2017.07.014.
[97] Kertes PJ, Galic IJ, Greve M, et al. Efficacy of a treat‑and‑extend regimen with ranibizumab in patients with neovascular age‑related macular disease: a randomized clinical trial[J]. JAMA Ophthalmol, 2020, 138(3): 244‑250. DOI: 10.1001/jamaophthalmol.2019.5540.
[98] Ohji M, Takahashi K, Okada AA, et al. Efficacy and safety of intravitreal aflibercept treat‑and‑extend regimens in exudative age‑related macular degeneration: 52‑and 96‑week findings from ALTAIR: a randomized controlled trial[J]. Adv Ther, 2020, 37(3): 1173‑1187. DOI: 10.1007/ s12325‑020‑01236‑x.
[99] Cui J, Sun D, Lu H, et al. Comparison of effectiveness and safety between conbercept and ranibizumab for treatment of neovascular age‑related macular degeneration: a retrospective case‑controlled non‑inferiority multiple center study[J]. Eye (Lond), 2018, 32(2): 391‑399. DOI: 10.1038/eye.2017.187.
[100] Martin DF, Maguire MG, Ying GS, et al. Ranibizumab and bevacizumab for neovascular age‑related macular degeneration[J]. N Engl J Med, 2011, 364(20): 1897‑1908. DOI: 10.1056/NEJMoa1102673.
[101] Horner F, Lip PL, Clark H, et al. Real‑world visual and clinical outcomes for patients with neovascular age‑related macular degeneration treated with intravitreal ranibizumab: an 8‑year observational cohort (AMD8) [J]. Clin Ophthalmol, 2019, 13: 2461‑2467. DOI: 10.2147/OPTH.S218378.
[102] Jacob J, Brié H, Leys A, et al. Six‑year outcomes in neovascular age‑related macular degeneration with ranibizumab[J]. Int J Ophthalmol, 2017, 10(1): 81‑90. DOI: 10.18240/ijo.2017.01.14.
[103] Gillies MC, Campain A, Barthelmes D, et al. Long‑term outcomes of treatment of neovascular age‑related macular degeneration: data from an observational study [J]. Ophthalmology, 2015, 122(9): 1837‑1845. DOI: 10.1016/j.ophtha.2015.05.010.
[104] Rofagha S, Bhisitkul RB, Boyer DS, et al. Seven‑year outcomes in ranibizumab‑treated patients in ANCHOR, MARINA, and HORIZON: a multicenter cohort study (SEVEN‑UP) [J]. Ophthalmology, 2013, 120(11): 2292‑2299. DOI: 10.1016/j.ophtha.2013.03.046.
[105] López Gálvez MI, Arias Barquet L, Figueroa MS, et al. Bimonthly, treat‑and‑extend and as‑needed ranibizumab in naïve neovascular age‑related macular degeneration patients: 12‑month outcomes of a randomized study[J]. Acta Ophthalmol, 2020, 98(7): e820‑e829. DOI: 10.1111/ aos.14399.
[106] Johnston RL, Carius HJ, Skelly A, et al. A retrospective study of ranibizumab treatment regimens for neovascular age‑related macular degeneration (nAMD) in Australia and the United Kingdom[J]. Adv Ther, 2017, 34(3): 703‑712. DOI: 10.1007/s12325‑017‑0483‑1.
[107] Oubraham H, Cohen SY, Samimi S, et al. Inject and extend dosing versus dosing as needed: a comparative retrospective study of ranibizumab in exudative age‑related macular degeneration[J]. Retina, 2011, 31(1): 26‑30. DOI: 10.1097/IAE.0b013e3181de5609.
[108] Garweg JG, Niderprim SA, Russ HM, et al. Comparison of strategies of treatment with ranibizumab in newly‑diagnosed cases of neovascular age‑related macular degeneration[J]. J Ocul Pharmacol Ther, 2017, 33(10): 773‑778. DOI: 10.1089/jop.2017.0006.
[109] Aurell S, Sjövall K, Paul A, et al. Better visual outcome at 1 year with antivascular endothelial growth factor treatment according to treat‑and‑extend compared with pro re nata in eyes with neovascular age‑related macular degeneration[J]. Acta Ophthalmol, 2019, 97(5): 519‑524. DOI: 10.1111/aos.13989.
[110] Hatz K, Prünte C. Treat and extend versus pro re nata regimens of ranibizumab in neovascular age‑related macular degeneration: a comparative 12 month study[J]. Acta Ophthalmol, 2017, 95(1): e67‑e72. DOI: 10.1111/ aos.13031.
[111] Wakuta M, Nomi N, Ogata T, et al. A trinity regimen with aflibercept for treatment‑naïve neovascular age‑related macular degeneration: 2‑year outcomes[J]. Graefes Arch Clin Exp Ophthalmol, 2020, 258(8): 1663‑1670. DOI: 10.1007/s00417‑020‑04745‑1.
[112] Spooner KL, Fraser‑Bell S, Cozzi M, et al. Macular atrophy incidence and progression in eyes with neovascular age‑related macular degeneration treated with vascular endothelial growth factor inhibitors using a treat‑and‑extend or a pro re nata regimen: four‑year results of the MANEX study[J]. Ophthalmology, 2020, 127(12): 1663‑1673. DOI: 10.1016/j.ophtha.2020.06.019.
[113] Pharmaceuticals N. Comparison of safety, effectiveness and quality of life outcomes between labeled versus "treat and extend" regimen in Turkish patients with choroidal neovascularisation due to age‑related macular degeneration (AMD) (salute) [EB/OL]. (2013‑05‑30) [2022‑01‑26]. https://clinicaltrials.gov/ct2/show/study/
[114] Rastoin O, Pagès G, Dufies M. Experimental models in neovascular age related macular degeneration[J]. Int J Mol Sci, 2020, 21(13): 4627. DOI: 10.3390/ijms21134627.
[115] Yang S, Zhao J, Sun X. Resistance to anti‑VEGF therapy in neovascular age‑related macular degeneration: a comprehensive review[J]. Drug Des Devel Ther, 2016, 10: 1857‑1867. DOI: 10.2147/DDDT.S97653.
[116] Amoaku WM, Chakravarthy U, Gale R, et al. Defining response to anti‑VEGF therapies in neovascular AMD[J]. Eye (Lond), 2015, 29(6): 721‑731. DOI: 10.1038/ eye.2015.48.
[117] Mantel I, Gianniou C, Dirani A. Conversion to aflibercept therapy versus continuing with ranibizumab therapy for neovascular age‑related macular degeneration dependent on monthly ranibizumab treatment[J]. Retina, 2016, 36(1): 53‑58. DOI: 10.1097/IAE.0000000000000664.
[118] Elwes F, Borooah S, Aspinall P, et al. Clinical outcomes of switching to aflibercept using a pro re nata treatment regimen in patients with neovascular age‑related macular degeneration who incompletely responded to ranibizumab[J]. BMC Ophthalmol, 2018, 18(1): 20. DOI: 10.1186/s12886‑018‑0688‑3.
[119] Barthelmes D, Campain A, Nguyen P, et al. Effects of switching from ranibizumab to aflibercept in eyes with exudative age‑related macular degeneration[J]. Br J Ophthalmol, 2016, 100(12): 1640‑1645. DOI: 10.1136/ bjophthalmol‑2015‑308090.
[120] Chatziralli I, Nicholson L, Vrizidou E, et al. Predictors of outcome in patients with neovascular age‑related macular degeneration switched from ranibizumab to 8‑weekly aflibercept[J]. Ophthalmology, 2016, 123(8): 1762‑1770. DOI: 10.1016/j.ophtha.2016.05.002.
[121] He L, Silva RA, Ayoub N, et al. Experience with aflibercept for the treatment of neovascular age‑related macular degeneration[J]. Ophthalmic Surg Lasers Imaging Retina, 2015, 46(5): 542‑549. DOI: 10.3928/23258160‑20150521‑05.
[122] Razavi S, Kodjikian L, Giocanti‑Aurégan A, et al. Efficacy and safety of intravitreal aflibercept in ranibizumab‑refractory patients with neovascular age‑related macular degeneration[J]. BMC Ophthalmol, 2021, 21(1): 90. DOI: 10.1186/s12886‑021‑01841‑6.
[123] Warwick AN, Leaver HH, Lotery AJ, et al. Fixed bimonthly aflibercept in naïve and switched neovascular age‑related macular degeneration patients: one year outcomes[J]. Int J Ophthalmol, 2016, 9(8): 1156‑1162. DOI: 10.18240/ ijo.2016.08.12.
[124] Li X, Zhang Y, Zhang Z, et al. One‑year outcomes of intravitreal conbercept for treatment‑resistant neovascular age‑related macular degeneration[J]. Ophthalmic Res, 2019, 62(2): 93‑100. DOI: 10.1159/
[125] Clemens CR, Alten F, Termühlen J, et al. Prospective PED‑study of intravitreal aflibercept for refractory vascularized pigment epithelium detachment due to age‑related macular degeneration: morphologic characteristics of non‑responders in optical coherence tomography[J]. Graefes Arch Clin Exp Ophthalmol, 2020, 258(7): 1411‑1417. DOI: 10.1007/s00417‑020‑04675‑y.
[126] Baxter JM, Fotheringham AJ, Foss AJ. Determining patient preferences in the management of neovascular age‑related macular degeneration: a conjoint analysis[J]. Eye (Lond), 2016, 30(5): 698‑704. DOI: 10.1038/ eye.2016.18.
[127] Kanesa‑Thasan A, Grewal DS, Gill MK, et al. Quantification of change in pigment epithelial detachment volume and morphology after transition to intravitreal aflibercept in eyes with recalcitrant neovascular AMD: 18‑month results [J]. Ophthalmic Surg Lasers Imaging Retina, 2015, 46(6): 638‑641. DOI: 10.3928/23258160‑20150610‑07.
[128] Kim K, Kim ES, Kim Y, et al. Outcome of intravitreal aflibercept for refractory pigment epithelial detachment with or without subretinal fluid and secondary to age‑related macular degeneration[J]. Retina, 2019, 39(2): 303‑313. DOI: 10.1097/IAE.0000000000001947.
[129] Major JC Jr, Wykoff CC, Croft DE, et al. Aflibercept for pigment epithelial detachment for previously treated neovascular age‑related macular degeneration[J]. Can J Ophthalmol, 2015, 50(5): 373‑377. DOI: 10.1016/j. jcjo.2014.12.012.
[130] Tran T, Dumas S, Coscas F. Two‑year outcome of aflibercept in patients with pigment epithelial detachment due to neovascular age‑related macular degeneration (nAMD) refractory to ranibizumab[J]. J Ophthalmol, 2017, 2017: 8984313. DOI: 10.1155/2017/
[131] Broadhead GK, Hong T, Zhu M, et al. Response of pigment epithelial detachments to intravitreal aflibercept among patients with treatment‑resistant neovascular age‑related macular degeneration[J]. Retina, 2015, 35(5): 975‑981. DOI: 10.1097/IAE.0000000000000409.
[132] He L, Silva RA, Moshfeghi DM, et al. Aflibercept for the treatment of retinal pigment epithelial detachments[J]. Retina, 2016, 36(3): 492‑498. DOI: 10.1097/IAE.0000000000000749.
[133] Capuano V, Miere A, Querques L, et al. Treatment‑naïve quiescent choroidal neovascularization in geographic atrophy secondary to nonexudative age‑related macular degeneration[J]. Am J Ophthalmol, 2017, 182: 45‑55. DOI: 10.1016/j.ajo.2017.07.009.
[134] de Oliveira Dias JR, Zhang Q, Garcia J, et al. Natural history of subclinical neovascularization in nonexudative age‑related macular degeneration using swept‑source OCT angiography[J]. Ophthalmology, 2018, 125(2): 255‑266. DOI: 10.1016/j.ophtha.2017.08.030.
[135] Yanagi Y, Mohla A, Lee SY, et al. Incidence of fellow eye involvement in patients with unilateral exudative age‑related macular degeneration[J]. JAMA Ophthalmol, 2018, 136(8): 905‑911. DOI: 10.1001/jamaophthalmol.2018.2154.
[136] Bailey ST, Thaware O, Wang J, et al. Detection of nonexudative choroidal neovascularization and progression to exudative choroidal neovascularization using OCT angiography[J]. Ophthalmol Retina, 2019, 3(8): 629‑636. DOI: 10.1016/j.oret.2019.03.008.
[137] Heiferman MJ, Fawzi AA. Progression of subclinical choroidal neovascularization in age‑related macular degeneration[J]. PLoS One, 2019, 14(6): e0217805. DOI: 10.1371/journal.pone.0217805.
[138] Yang J, Zhang Q, Motulsky EH, et al. Two‑year risk of exudation in eyes with nonexudative age‑related macular degeneration and subclinical neovascularization detected with swept source optical coherence tomography angiography[J]. Am J Ophthalmol, 2019, 208: 1‑11. DOI: 10.1016/j.ajo.2019.06.017.
[139] Mueller S, Agostini H, Ehlken C, et al. Patient preferences in the treatment of neovascular age‑related macular degeneration: a discrete choice experiment[J]. Ophthalmology, 2016, 123(4): 876‑883. DOI: 10.1016/j. ophtha.2015.12.001.
[140] Visser MS, Amarakoon S, Missotten T, et al. SF‑6D utility values for the better‑and worse‑seeing eye for health states based on the Snellen equivalent in patients with age‑related macular degeneration[J]. PLoS One, 2017, 12(2): e0169816. DOI: 10.1371/journal.pone.0169816.
[141] Choi S, Park SM, Jee D. Utility values for age‑related macular degeneration patients in Korea[J]. PLoS One, 2018, 13(7): e0201399. DOI: 10.1371/journal. pone.0201399.
[142] Yanagi Y, Ueta T, Obata R, et al. Utility values in Japanese patients with exudative age‑related macular degeneration [J]. Jpn J Ophthalmol, 2011, 55(1): 35‑38. DOI: 10.1007/ s10384‑010‑0893‑y.
[143] Zhou B, Mitchell TC, Rusakevich AM, et al. Noncompliance in prospective retina clinical trials: analysis of factors predicting loss to follow‑up[J]. Am J Ophthalmol, 2020, 210: 86‑96. DOI: 10.1016/j.ajo.2019.10.012.
[144] Ehlken C, Wilke T, Bauer‑Steinhusen U, et al. Treatment of neovascular age‑related macular degeneration patients with vascular endothelial growth factor inhibitors in everyday practice: identification of health care constraints in Germany‑the PONS study[J]. Retina, 2018, 38(6): 1134‑1144. DOI: 10.1097/IAE.0000000000001681.
[145] Parikh R, Pirakitikulr N, Chhablani J, et al. A multinational comparison of anti‑vascular endothelial growth factor use: the United States, the United Kingdom, and Asia‑Pacific[J]. Ophthalmol Retina, 2019, 3(1): 16‑26. DOI: 10.1016/j.oret.2018.08.002.
[146] Argon laser photocoagulation for neovascular maculopathy: five‑year results from randomized clinical trials. Macular Photocoagulation Study Group[J]. Arch Ophthalmol, 1991, 109(8): 1109‑1114.
[147] Laser photocoagulation for neovascular lesions nasal to the fovea. Results from clinical trials for lesions secondary to ocular histoplasmosis or idiopathic causes. Macular photocoagulation study group[J]. Arch Ophthalmol, 1995, 113(1): 56‑61.
[148] Lee WK, Iida T, Ogura Y, et al. Efficacy and safety of intravitreal aflibercept for polypoidal choroidal vasculopathy in the PLANET study: a randomized clinical trial[J]. JAMA Ophthalmol, 2018, 136(7): 786‑793. DOI: 10.1001/jamaophthalmol.2018.1804.
[149] Wong TY, Ogura Y, Lee WK, et al. Efficacy and safety of intravitreal aflibercept for polypoidal choroidal vasculopathy: two‑year results of the aflibercept in polypoidal choroidal vasculopathy study[J]. Am J Ophthalmol, 2019, 204: 80‑89. DOI: 10.1016/j. ajo.2019.02.027.
[150] Lim TH, Lai T, Takahashi K, et al. Comparison of ranibizumab with or without verteporfin photodynamic therapy for polypoidal choroidal vasculopathy: the Everest Ⅱ randomized clinical trial[J]. JAMA Ophthalmol, 2020, 138(9): 935‑942. DOI: 10.1001/jamaophthalmol.2020.2443.
[151] Koh A, Lee WK, Chen LJ, et al. Everest study: efficacy and safety of verteporfin photodynamic therapy in combination with ranibizumab or alone versus ranibizumab monotherapy in patients with symptomatic macular polypoidal choroidal vasculopathy[J]. Retina, 2012, 32(8): 1453‑1464. DOI: 10.1097/IAE. 0b013e
[152] Li X, Qu J, Su G, et al. The comparison of two different strategies of intravitreal conbercept for polypoidal choroidal vasculopathy in Chinese patients results from a 48‑week randomized phase 4 study: STAR study[J]. Acta Ophthalmol, 2022. DOI: 10.1111/aos.15272.
[153] Martin DF, Maguire MG, Fine SL, et al. Ranibizumab and bevacizumab for treatment of neovascular age‑related macular degeneration: two‑year results[J]. Ophthalmology, 2012, 119(7): 1388‑1398. DOI: 10.1016/ j.ophtha.2012.03.053.
[154] Kim K, Yang J, Feuer W, et al. A comparison study of polypoidal choroidal vasculopathy imaged with indocyanine green angiography and swept‑source optical coherence tomography angiography[J]. Am J Ophthalmol, 2020, 217: 240‑251. DOI: 10.1016/j.ajo.2020.05.017.
[155] Miere A, Querques G, Semoun O, et al. Optical coherence tomography angiography changes in early type 3 neovascularization after anti‑vascular endothelial growth factor treatment[J]. Retina, 2017, 37(10): 1873‑1879. DOI: 10.1097/IAE.0000000000001447.
[156] Wong TY, Chakravarthy U, Klein R, et al. The natural history and prognosis of neovascular age‑related macular degeneration: a systematic review of the literature and meta‑analysis[J]. Ophthalmology, 2008, 115(1): 116‑126. DOI: 10.1016/j.ophtha.2007.03.008.
[157] Al‑Sheikh M, Iafe NA, Phasukkijwatana N, et al. Biomarkers of neovascular activity in age‑related macular degeneration using optical coherence tomography angiography[J]. Retina, 2018, 38(2): 220‑230. DOI: 10.1097/IAE.0000000000001628.
本文献转自中华眼科杂志 2023 年5 月第 59 卷第 5 期,不代表本网站赞同其观点和对其真实性负责,我们主要用于阅读分享,非商业用途,如若侵权,请告知删除。

