4.1 引言
皮肤是人体的主要器官之一。它覆盖全身,与人体其它器官密切相连,起着保护人体不受外部刺激或伤害的作用。人的皮肤从表面上来看是薄薄的一层,但如果把它放在显微镜下面仔细观察,就会清楚的看到皮肤由外及里共分为三层:皮肤的最外层叫表皮:中间一层叫真皮:最里面的一层叫皮下组织。表皮是皮肤的最外层包含各种大小不同的鳞片状上皮细胞,由基层发育而成。此基层位于真皮之上,在发育过程中不断的产生新细胞。表皮细胞还能够进一步细分为基底层、棘层、颗粒层、透明层和角质层。表皮细胞之间排列非常紧密,能够对一些化学物质和水分有屏障作用,因此能够保护真皮和皮下组织[1]。皮肤衰老的主要原因发生在真皮,真皮是皮肤的主要构成部分。真皮由弹力纤维、胶原纤维和网状纤维组成的结缔组织与纤维束间的无定型基质构成,真皮的厚度随身体部位功能的不同而异。皮肤衰老或者长期过度日晒会使皮肤产生皱纹、弹性松弛,是胶原纤维及弹力纤维变性或断裂的结果。
人体会在内源性或外源性因素的诱导下产生活性氧(ROS)和活性氨(RNS)。与此同时,人体自身防御系统能够清除细胞中的自由基。但是,随着年龄的增长和外界刺激如环境污染、紫外光照射和炎症条件下,自由基的产生会增加数倍[2]。自由基的产生和通过人体自身抗氧化系统的清除导致氧化应激[3],氧化应激会损伤很多生物分子,因而导致多种疾病的形成[4]。在这种情况下,通过外源性补充抗氧化剂来清除体内自由基就显得尤为重要[3]。在食品和化妆品领域,由于众多合成的抗氧化剂存在潜在的致癌性而让人们对天然的抗氧化剂的研究与应用越来越重视[6]。芳香植物,尤其是其挥发油是很好的天然抗氧化剂[7]。如今,人们致力于研究天然植物的挥发油,因为其相对安全、容易被消费者接受、在化妆品、食品、药品等领域应用广泛、容易获得并且相对廉价[8]。
紫外照射是黑色素形成的一一个关键因素[9],之前有研究证明了紫外照射诱导的ROS和RNS过量产生会使黑色素增多[10]。使用防晒霜是目前最流行的减少紫外线对皮肤损伤的方法[11]。纳米二氧化钛广泛应用于防晒产品中[12]。但是,最近有研究表明纳米二氧化钛促进含水环境中颗粒表面光诱导产生活性氧[13,14]。另一方面,在正常的阳光照射环境下,汗水的蒸发能够提高皮肤表面亚硝酸盐的量[15-17]。因此,由于紫外光的照射,纳米二氧化钛和亚硝酸盐会导致蛋白质氧化和酪氨酸硝化。蛋白质酪氨酸硝化不仅会引起蛋白质结构和功能的改变,而且会额外增加光引起的氧化损伤。因此,蛋白质氧化和酪氨酸硝化可以认为是纳米二氧化钛对皮肤的损伤。
本章通过三种不同抗氧化试验来研究三种挥发油的抗氧化活性,同时研究三种挥发油对UV-TiO2-NO2 诱导的蛋白质氧化和硝化的保护作用。
4.2材料与方法
4.2.1试剂与仪器
4.2.1.1主要试剂
2,4-二硝基苯肼(DNPH).牛血清蛋白( BSA)、二叔丁基对甲酚( Butylated hydroxytoluene, BHT)、兔多克隆抗二硝基苯酚抗体、兔多克隆抗3-硝基酪氨酸抗体:美国Sigma 公司;超氧阴离子自由基试剂盒:南京建成生物研究所;三羟甲基氨基甲烷(Tris)、2,4-二硝基苯肼( 2,4-dinitrophenylhydrazine, DNPH)、考马斯亮蓝R-250、十二烷基硫酸钠(SDS)、 吐温(Tween-20)、 考马斯亮蓝G-250、丽春红:美国Amersco公司;ECL发光试剂、辣根过氧化物酶标记的羊抗兔IG(H+L): 美国Pierce 公司;甲叉双丙烯酰胺、溴酚蓝、丙烯酰胺:瑞典Pharmacia公司;硝酸纤维素膜:美国Millipore 公司。
4.2.1.2主要仪器
SPECTR Amax PULS384型酶标仪:美国Sunnyvale公司;
DYCP-40C型电泳槽:北京六一-仪器厂;
Milli-Q Synthesis超纯水系统:国美Millipore 公司;
SSQ-H型不锈钢恒温水浴锅:上海三 申医疗器械有限公司;
DYY-7C型电泳仪:北京六一仪器厂;
UV7500型紫外-可见分光光度计:.上海 天美科学仪器有限公司;
X型胶片及感光暗盒:美国Kodak 公司;
4.2.1.3溶液的配置:
SDS-聚丙烯酰胺凝胶溶液的配制
电泳工作液:
①30%(w/v)丙烯酰胺单体储存液: 29.2 g丙烯酰胺,0.8 g双丙烯酰胺,溶于100 mL二次水中,储藏于棕色瓶中4C保存备用;
②1.5 M Tris-HCl (pH= >8.8):将36.34g Tris碱溶于150 mL二次水中,用浓盐酸调节pH值至8.8, 最后加二次水到总体积为200 mL,4C保存;
③1.0 M Tris-HCl (pH=6.8): 12.10g Tris 碱溶于50 mL二次水中,用浓盐酸调节pH值至6.8,最后加二次水到总体积为100mL,4C保存;
④10%过硫酸胺:使用小管分装,于-20°C 保存;
⑤5x电泳缓冲液: 15.1 gTris碱,94g甘氨酸,5g SDS 溶于1000 mL二次水中,室温条件下保存;
1x样品缓冲液(10 mL): 1.0mL甘油,1.25 mL Tris-HCl(0.5M,pH=6.8), 1.5mL 20% SDS(w/v), 0.5mLβ_巯基乙醇,2.0mL 0.1%溴酚蓝,3.75 mL二次水,4'C保存;
考马斯亮蓝染色液: 0.25g 考马斯亮蓝R-250, 112.5mL 甲醇,25 mL冰醋酸,然后加二次水定容至总体积1000 mL;
考马斯亮蓝脱色液:甲醇50 mL,冰醋酸50 mL,二次水400 mL。
Western blot所用溶液的配制:
半干转移缓冲液: 5.8g Tris碱,2.9g 甘氨酸,200 mL甲醇,0.37 gSDS,然后加二次水至总体积1000 mL;
TBS-T:8.77g氯化钠,3.15 g Tris-HCl溶于950 mL二次水中,然后用1M氢氧化钠溶液调节pH值至7.4, 最后加入0.5 mL Tween-20并补加二次水至总体积为1000mL, 4C保存;
封闭液: 5%脱脂奶粉( TBS-T溶解);
丽春红染色液: 3%三氯乙酸(w/v),0.2% 丽春红(w/v),3%磺基水杨酸(w/v);
4.2.2超氧阴离子清除实验
运用超氧阴离子自由基试剂盒检测样品对超氧阴离子自由基的清除能力。溶液的配置和样品的检测方法按照试剂盒说明书操作。槲皮素作为阳性对照。超氧阴离子清除率的计算方法:
抑制率%= (Ablamk -Asample)/AblankX 100 Aplamk和Asample 分别表示不添加实验样品和添加实验样品时的吸光度。
4.2.3 ABTS阳离子(ABTS*)清除实验
ABTS阳离子清除实验参照Re等[18] 和Gao等[19的方法。ABTS 溶解于蒸馏水,浓度为7mM。溶液中加入MnO2粉末并在黑暗环境下室温保存超过24小时,用注射器式过滤器过滤并在黑暗环境中放置6小时后使用。获得的ABTS 阳离子以这种形式在黑暗环境中室温保存超过2天。含有ABTS阳离子的母液用乙醇稀释至其吸光度值在734 nm波长下为0.70 (+0.02)。每种样品稀释至适当的浓度。100μL稀释的样品与1.2mL稀释的ABTS阳离子溶液反应,从反应开始到2分钟,记录分光光度计在734nm波长处的吸光度值。
自由基清除率% = (Ablank -Asample)AblankXx 100
其中Ablank代表没有添加实验样品时的吸光度值,Asample代表添加实验样品时的吸光度值。槲皮素作为阳性对照。
4.2.4脂质过氧化的测定
实验方法参照Mihara and Uchiyamal20]和Hermes-Lima等[21。 亚油酸作为抗脂质过氧化的底物。将0.2804g 的亚油酸、0.2840g 的吐温20、 50 mL磷酸缓冲溶液(pH7.0)混合为均匀的乳浊液。乳浊液现用现配,不可存储。200 μL样品溶解于DMSO,加入2mL亚油酸乳状液,然后加入氯化亚铁(100 μL,0.6 mmol/L, 溶剂为3.5%的盐酸)和过氧化氢(400 μL,25 mmol/L);对照组为2500 μL磷酸缓冲溶液和200 uL样品溶液。剧烈震荡后,反应混合液在37°C 静置60分钟;加入2.0mL 1%的TAB溶液(含有0.002% BHT, 0.8% TCA, 0.8% SDS)在95°C反应30分钟。过氧化值通过分光光度计在550nm波长处的吸光度值来体现。Trolox作为阳性对照。
脂质过氧化的抑制率% = (Ablank-Asample)/ AblankX 100
其中Ablank表示未添加实验样品的吸光度值,Asample表示添加了实验样品的吸光度值。
4.2.5纳米TiO2- NO2 -UV诱导的蛋白质氧化和酪氨酸硝化测定
实验方法参照本实验室之前的方法[21并做略微修改。BSA(1.0mg/mL),NaNO2 (1.0 mmol/L)和悬浮的TiO2(50μg/mL) 与pH7.0的0.1 mol/L PBS充分混合(总体积3 mL)。混合液移入24孔板直接暴露在光源下。365 nm波长的紫外光照射时反应开始。365 nm波长紫外光照射4小时,10000 转/分钟离心15 分钟去除TiO2,上清液备用。
4.2.5.1蛋白质氧化测定
取处理好的.上清液100 μL,加入100μL含3%SDS的10 mmol/L DNPH,室温下反应45分钟(每隔几分钟使用漩涡仪充分混匀),冰浴下加入200 μL的中和液(2 mol/L Tris, 30%甘油)终止反应。然后样品与280μL的2x.上样缓冲液,混匀后于-20 C储存备用。进行10% SDS-PAGE。电泳完毕后,运用半干转移法将蛋白质转移到硝酸纤维素膜上,在室温条件下将印迹膜放入封闭液(5%脱脂奶粉)中搅动孵育1.5 小时。孵育完毕后,用TBS-T漂洗4次,每次10分钟。然后用兔多克隆抗3-DNP抗体(1: 4000 )孵育印迹膜(4 C,1.5 小时),接着继续用TBS-T漂洗4次,每次10分钟;然后室温下用辣根过氧化物酶标记的羊抗兔IgG (二抗,1: 4000) 孵育印迹膜1小时,再用TBS-T溶液漂洗5次,每次10分钟。最后采用化学发光法检测。
4.2.5.2蛋白质硝化的测定
150 μL.上清液与150 ul 2x.上样缓冲液混匀后于100 °C沸水中反应3分钟,进行10% SDS-PAGE。
SDS-聚丙烯酞胺凝胶电泳:在12% SDS -聚丙烯酰胺凝胶电泳中进行分离。
蛋白印迹:电泳完成以后,利用半干转移法将蛋白质转移到硝酸纤维素膜上,在室温条件下将印迹膜放入封闭液(5%脱脂奶粉)中孵育1.5 小时。孵育完毕后, TBS-T溶液漂洗4次,每次10分钟。然后用兔多克隆抗3-硝基酪氨酸抗体(一抗,1:800) 室温条件下孵育印迹膜1.5 小时,TBS-T溶液漂洗4次,每次10分钟;然后用辣根过氧化物酶标记的羊抗兔IgG( 二抗,1:3000) 室温条件下孵育印迹膜1小时,然后再用TBS-T溶液漂洗4次,每次10分钟。最后用化学发光法检测。
4.2.6数据统计
所有实验结果均至少重复3次,实验结果以X士SD来表示,差异显著性分析采用组间t检验法。p<0.05, 认为两组数据间有显著差异; p<0.01, 认为两组数据间有非常显著性差异。
4.3试验结果
4.3.1山苍子油及其活性成分对ABTS*的清除能力测定
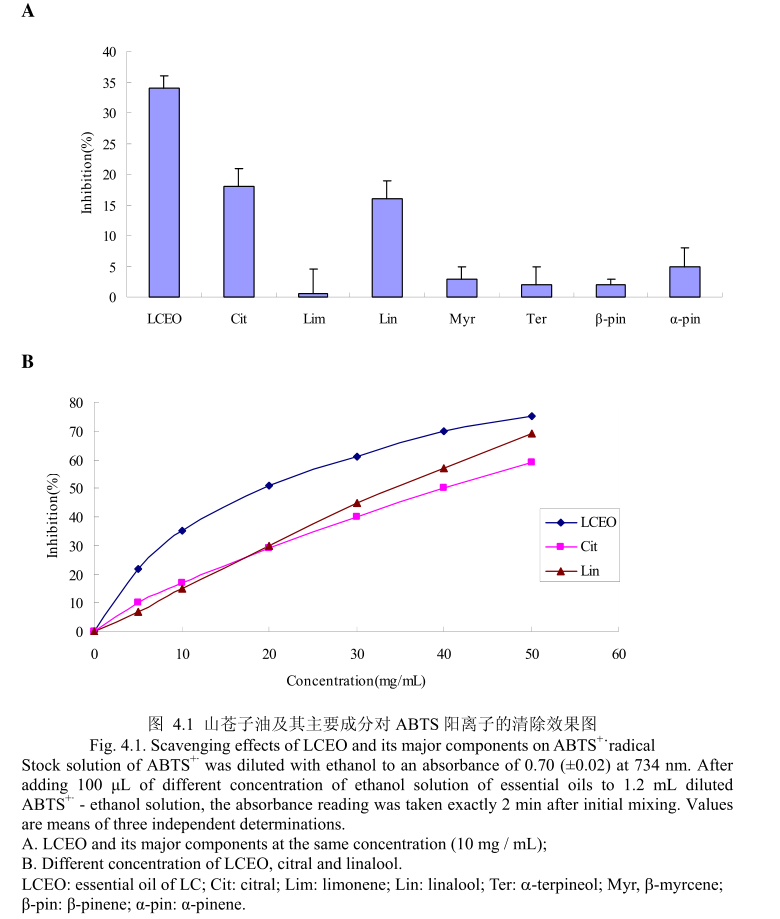
ROS在调节角蛋白细胞和黑素细胞增殖方面有重要作用,同时在调节黑素细胞生成黑色素方面也有重要作用。而能够清除ROS和抑制ROS产生的物质如抗氧化剂,能够减少色素沉着或者阻止紫外线诱导的黑素生成[23,24]。为了测定LCEO和其主要成分是否具有抗氧化活性,通过清除ABTS+来测定。LCEO和其主要成分对ABTS+的清除能力如图4.1 (A)。 LCEO在浓度为10mg/mL时被证明具有很强的抑制ABTS+产生的能力,柠檬醛和芳樟醇在相同浓度下表现出一定的抑制能力,柠檬烯、β-月桂烯、a-松油醇、β-蒎烯、a-蒎烯在该浓度下表现出的抑制活性可以忽略不计。结果表明柠檬醛和芳樟醇是LCEO中清除ABTS+的活性成分。如图4.1 (B),进一步测定了不同浓度下的LCEO和其活性成分对ABTS+的清除能力。从图中可以看出,ABTS+的清除能力与使用剂量相关。各种成分的ICso 的值按照逐渐递减的顺序为:柠檬醛>芳樟醇>
LCEO。从而证明LCEO比另外两种活性成分有着更强的清除ABTS+ 的能力。 将LCEO对ABTS+ 的清除能力与槲皮素比较,LCEO的半抑制浓度为17.75+0.89mg/ mL,低于槲皮素的半抑制浓度为4.5+0.9 ug / mL。
4.3.2 山苍子油及其活性成分对 0-·的清除能力测定

山苍子油及其活性成分对〇的清除能力测定如图4.2(A)所示,在浓度为5mg/mL 的情况下,柠檬醛和LCEO对O的抑制率分别为37%和 28%,而其它组分在相同的浓度下表现出的抑制能力在5%-15%之间。证明LCEO 具有一定的清除 O,的能力,其主要活性成分为柠檬醛。如图4.2(B)所示,当LCEO 和柠檬醛的浓度从 2.5mg/mL增加到20mg/mL 时,LCEO 和柠檬醛对 O的清除活性增加。而且,LCEO 和柠醛表现出相似的清除能力。将LCEO的抗氧化能力与槲皮素作比较,LCEO对0的半抑制浓度为10.2+0.12mg/m,而皮素的半抑制浓度为 10.3+0.4μg/m。结果表明皮素的抗氧化能力强于 LCEO。
4.3.3 LCEO 和柠檬醛对 UV-TiO,-NO,催化的蛋白质氧化损伤的保护
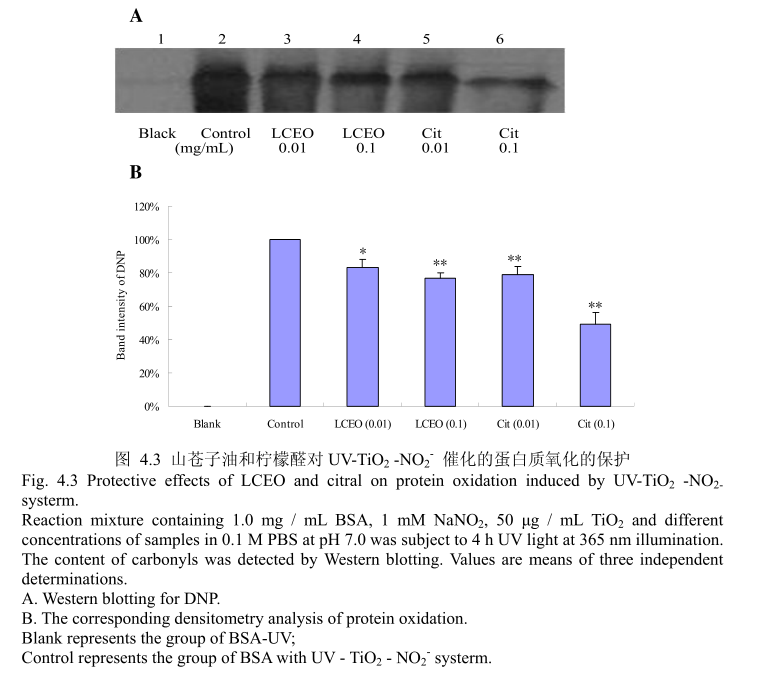
蛋白质氧化是对蛋白质的氧化修饰,改变了蛋白质的结构和功能。蛋白质的氧化常常存在于生理和病理状态下。因此,蛋白质氧化可能存在于纳米TO,对皮肤的毒性过程中。实验使用牛血清蛋白(BSA)作为模型蛋白,然后用SDS-PAGE和蛋白质印迹法检测。如图4.3(A)和(B),蛋白质氧化通过添加0.01mg/mL(最低浓度)的LCEO或柠檬醛被抑制。与此同时,所有的样品都具有较强的保护作用,并且明显呈剂量相关性。当LCEO或柠醛的浓度达到0.1mg/m时,表现出的抑制蛋白质氧化的能力更强。此外,在相同的浓度条件下,柠檬醛比LCEO 表现出更强的抑制蛋白质氧化的能力。
4.3.4LCEO 和柠檬醛对 UV-TiOz-NO,催化的蛋白质硝化损伤的保护
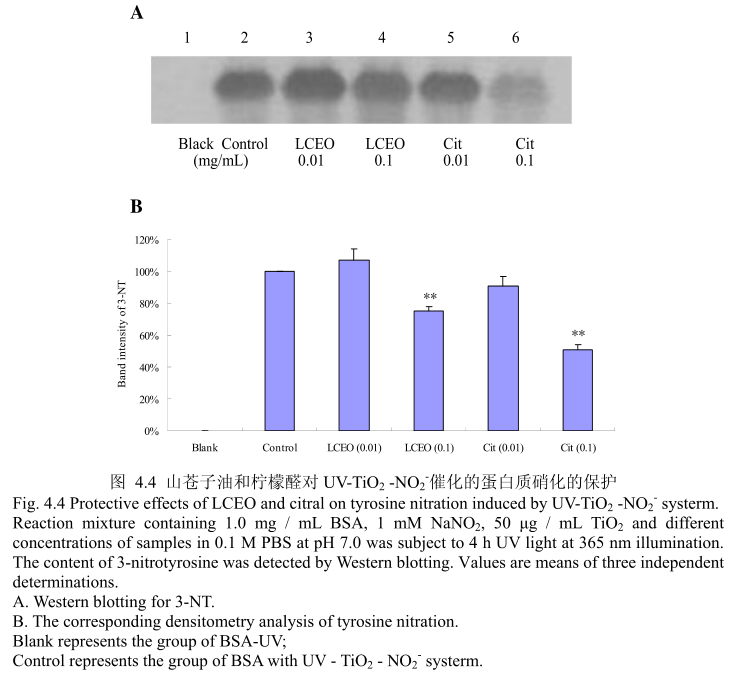
蛋白质硝化是机体在氮氧化物存在的条件下氧化损伤的特殊形式,主要是指蛋白质中含有的酪氨酸残基被硝化成3-硝基酪氨酸(3-Nitro-Tytosine, 3~NT),即一个硝基(-NO2)添加在酪氨酸残基的羟基邻位上。蛋白质硝化在病理状态下常伴随着活性氮和活性氧的增加而产生。目前,蛋白质酪氨酸硝化已经被确认为是一-种重要的蛋白质翻译后的修饰,并且与炎症和神经退行性疾病、心血管疾病等多种病症密切相关,其产物3-硝基酪氨酸(3-NT) 作为NO、ONOO~等活性氮的衍生物,可以被认为是许多生理和病理状态下的生物标志物(Biomarker)[5]126。将3-硝基酪氨酸作为酪氨酸硝化的检测指标,LCEO和柠檬醛对蛋白质硝化的抑制效果如图4.4 (A)和(B)。当LCEO或柠檬醛的的浓度为0.01 mg/mL时,并没有表现出较强的抑制蛋白质硝化的能力,当LCEO 或柠檬醛的浓度达到0.1 mg/ mL时,才能表现出较强的蛋白质硝化的抑制活性。
4.3.5丁香花蕾油及其主要成分对O2的清除能力测定
超氧阴离子作为更多活性氧的前体对细胞结构有着很大的损伤,导致组织损伤和不同的疾病[26]。
丁香花蕾油和其主要成分丁香酚对O2” 的清除活性如图4.5。结果表明丁香花蕾油的比丁香酚表现出更强的清除O2”的能力。丁香花蕾油的浓度分别为10ug/mL、30 ug/mL、60μg/mL时,超氧阴离子的清除能力为29.8%, 41.5%,50.5%,而对于相同浓度的丁香酚,其对超氧阴离子的清除能力分别为20.4%, 25.3%,30.8%。当丁香酚或丁香花蕾油的量增加时,抑制能力并没有明显的变化。这可能是由于其在水中的溶解性较低的缘故,当溶解到一定量时,增加的量并不能溶解于测试溶剂,从而不能发挥抑制作用。丁香花蕾油的对超氧阴离子的半抑制浓度为58ug/mL,低于槲皮素的半抑制浓度为10.3 ug / mL。
4.3.6 丁香花蕾油及其主要成分对 ABTS*的清除能力测定
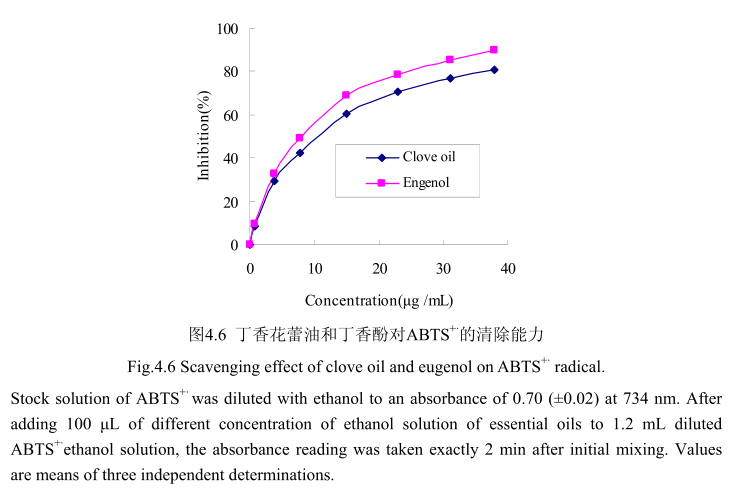
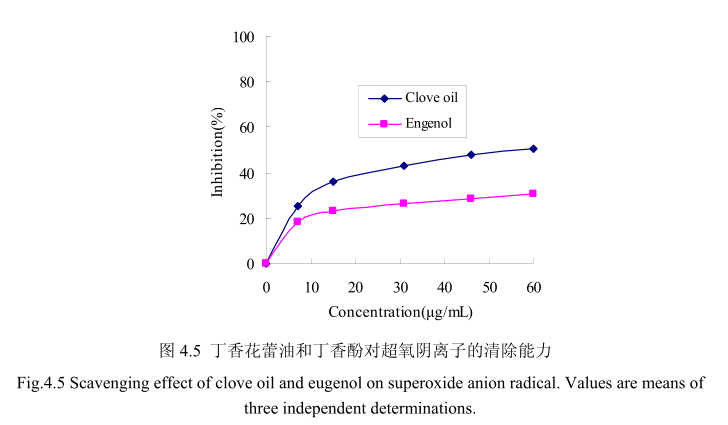
丁香花蕾油和其主要成分丁香酚对ABTS+的清除活性如图4.6 所示。丁香花蕾油和丁香酚都表现出较高的清除活性。当丁香花蕾油的浓度为0.8-38μg/mL时,其清除活性为8.7%-80.9%, 在相同浓度范围内,丁香酚的清除率为9.7%-89.6%。当丁香花蕾油的浓度从0μg/mL逐渐增加到15μg/mL时,对ABTS+的清除率急剧增加(从0增加到70%左右);当丁香酚的浓度从0μg/mL逐渐增加到15μg/ mL时,对ABTS+的清除率亦明显增加(从0增加到60%左右)。当丁香花蕾油的浓度从15 ug/mL逐渐增加到40 ug/mL时,对ABTS+的清除率增加量逐渐变缓(从70%增加到89.6%);当J香酚的浓度从15 ug/ mL逐渐增加到40μg/mL时,对ABTS+的清除率从60%增加到79%。丁香花蕾油和丁香酚的半抑制率分别为8.5 μug/ mL和7.7 ug/ mL,与槲皮素的半抑制浓度4.5 ug/ mL相比差别不大。
4.3.7香茅油及其主要成分对O2-.的清除能力测定
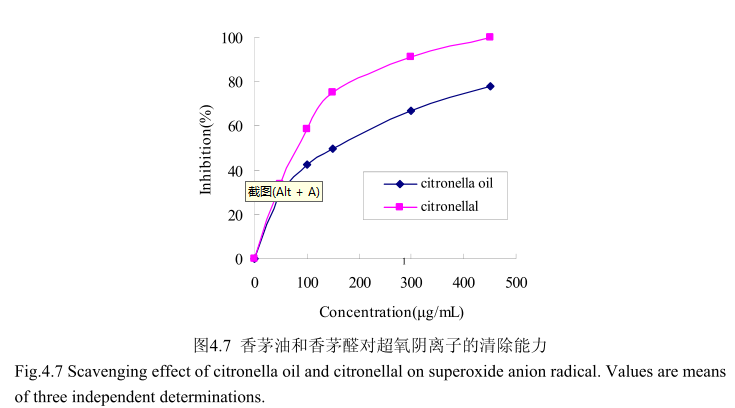
香茅油及其主要成分香茅醛对超氧阴离子的清除活性如图4.7所示。香茅油的半抑制浓度(ICso:150μg/mL)大于香茅醛的半抑制浓度(ICso:90μg/mL),说明香茅油对超氧阴离子的抑制活性弱于香茅醛。当香茅醛的浓度为450mg/m时,其对超氧阴离子的清除活性达到100%,而香茅油在该浓度下的清除活性仅为78%。香茅油对超氧阴离子的半抑制浓度为150mg/mL,说明其对超氧阴离子的清除能力弱于槲皮素(10.3μg/mL)。当香茅油的浓度从0g/m增加到50μg/m时,对超氧阴离子的抑制能力显著增加,随着香茅油的浓度逐渐增大,对超氧阴离子的清除能力的增加量逐渐变缓。当香茅醛的浓度0mg/m增加到150mg/m时,对超氧阴离子的清除能力显著增加(从0增加到78%左右),而当香茅醛的浓度从150g/m增加到500μg/m 时,清除能力增加的较为缓慢(从78%增加到 100%)。
4.3.8 香茅油及其主要成分对 ABTS*的清除能力测定
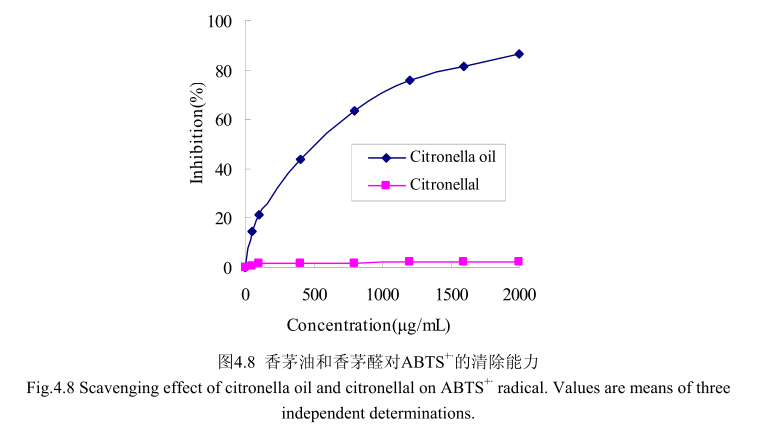
如图4.8所示,当香茅油的浓度范围在50-2000g/m时,其对 ABTS”的清除率为 14.5%-86.4%。尽管香茅油在低浓度时100g/m 时的抑制率仅为20%,但是香茅油的浓度从0g/m增加到100gm时,对ABTS*的清除能力显著增加;随着香茅油的浓度从100g/mL增加到2000g/mL时,对ABTS*的清除能力缓慢增加,且增加趋势逐渐变缓。而香茅油的主要成分香茅醛在相同的浓度条件下并没有表现出清除能力。而香茅油半抑制浓度为500g/m,远远大于皮素 4.5μg/m,从而说明香茅油的抗氧化活性较弱,
4.3.9丁香花蕾油和香茅油对脂质过氧化的保护作用
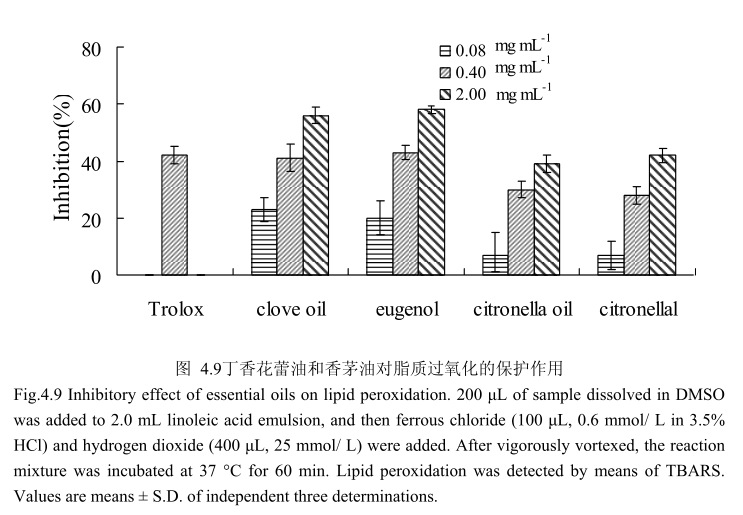
丁香花蕾油和香茅油及其主要成分对脂质过氧化的抑制作用如图4.9所示,丁香花蕾油、香茅油、丁香酚、香茅醛都具有抗脂质过氧化的作用,并且随着剂量的增加,抗氧化活性逐渐增强。在相同的浓度条件下,丁香花蕾油和丁香酚的抗氧化能力强于香茅油和香茅醛。当浓度为0.4mg/m时,丁香花蕾油和丁香酚抗脂质过氧化的能力与 Trolox(阳性对照)相似。
4.3.10 丁香花蕾油和香茅油对 UV-TiO,-NO,催化的蛋白质氧化损伤的保护
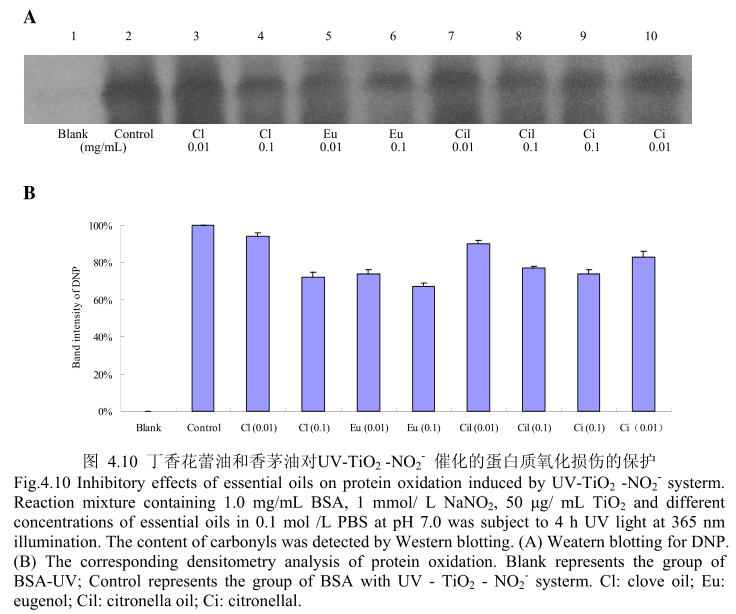
丁香花蕾油和香茅油对 UV-TiO2 -NO,催化的蛋白质氧化的抑制作用如图4.10A 和 B所示,当丁香花蕾油、丁香酚、香茅油、香茅醛以最低浓度0.01mg/ml 进行加样时,都具有抑制蛋白质氧化的能力。在该浓度下,丁香花蕾油和香茅油表现出相似的抑制蛋白质氧化的能力,丁香酚的抑制蛋白质氧化的能力强于丁香花蕾油,香茅醛的抑制蛋白质氧化的能力强于香茅油,丁香酚的抑制蛋白质氧化的能力强于香茅醛。当加样浓度增加到0.1mg/m 时,丁香花蕾油、丁香酚、香茅油、香茅醛均具有较好的抗氧化能力。在该浓度下,丁香花蕾油、香茅油、香茅醛表现出相似的抑制蛋白质氧化的能力,但在该浓度下其抗氧化活性弱于丁香酚。
4.3.11 丁香花蕾油和香茅油对 UV-TiO,-NO,催化的蛋白质硝化损伤的保护
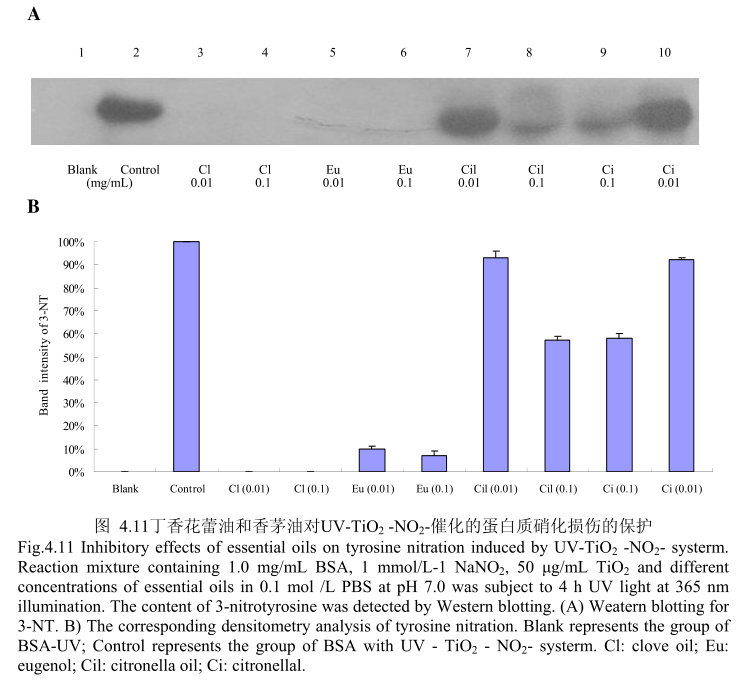
丁香花蕾油和香茅油对UV-TiO2-NO,催化的蛋白质硝化的抑制作用如图4.11,当丁香花蕾油的浓度为0.01mg/m和0.1mg/m 时,均能够完全抑制硝化的产生。而香茅油和其主要成分香茅醛在浓度为0.01mg/m时,几乎没有抑制蛋白质硝化的能力,当香茅油和香茅醛的浓度为0.1mg/mL时,表现出一定的抑制蛋白质硝化的能力。
4.4讨论
挥发油是芳香植物的次生代谢产物,有着明显的气味,是具有挥发性的混合物。在自然界,挥发油在保护植物方面有着重要作用,如抗病毒、抗细菌、杀灭昆虫和减少昆虫食用植物的欲望。目前已经发现大约3000 种挥发油,而其中有300种具有重要的商业价值,被用于制药、农业、食品、卫生、化妆品和香料领域。很多挥发油同时也是天然的抗氧化剂,如薄荷油[27-29]、迷迭香油[30-33]、鼠尾草油[34]、芫荽子油[27,29]、小茴香油[35]、百里香油[36]等。挥发油能够作为香精的原料加入到化妆品中,同时也可以作为天然防腐剂或者活性成分用于化妆中。此外,挥发油常常与其它植物油脂按照适当的比例调配后直接涂抹于皮肤,不仅能够放松神经,还能发挥挥发油特有的功效。因此,研究出一-些具有特殊功效的挥发油具有重要意义。
皮肤是人体抵御损伤的屏障,是将人体与外界环境隔开的重要屏障。持续的暴露在紫外光下会导致皮肤损伤相关的众多并发症,当紫外光引起的损伤超过人体黑.色素提供的保护能力时就会形成晒斑[37,38]。系外线诱导皮肤光损伤,导致皮肤的细胞基质发生改变,引起皱纹、皮肤松弛、粗糙、色素沉着、表皮增厚和结缔组织变化[39,40]。结缔组织各组分( 包括胶原、蛋白聚糖类、糖蛋白类)之间的平衡被打破
会导致不利影响,如表皮成纤维细胞光老化。皮肤自身具有抗氧化防御能力,能够清除包含自由基在内的活性氧,但是如果紫外光达到一定的强度时会超出这些防御系统的清除能力,从而导致自由基损伤细胞的组分,如蛋白质、脂类和DNA[41.42]。活性氧诱导的氧化应激能够最终导致细胞凋亡或细胞坏死[43]。活性氧在人体内的积累,在人体皮肤内源性损伤和光老化方面起着决定性作用,同时与皮肤炎症和皮肤癌有着密切的关系[44,45]。本章通过体外实验研究了丁香花蕾油、山苍子油、香茅油对自由基的清除能力。通过实验发现,LCEO在浓度为10 mg 1 mL时被证明具有很强的抑制ABTS阳离子产生的能力,柠檬醛和芳樟醇在相同浓度下表现出一定的抑制能力,柠檬烯、β-月桂烯、a-松油醇、β-蒎烯、a-蒎烯在该浓度下表现出的抑制活性可以忽略不计。LCEO对ABTS阳离子的半抑制浓度为17.75+0.89mg/ mL。在浓度为5mg/mL 的情况下,柠檬醛和LCEO对O2~ 的抑制率分别为37%和28%,而其他组分在相同的浓度下表现出的抑制能力在5%-15%之间。
LCEO对02”的半抑制浓度为10.2+0.12mg1mL。当香茅油的浓度范围在50-2000 μg / mL时,其对ABTS+的清除率为14.5%-86.4%。 从而说明香茅油对ABTS+的清除能力较弱。香茅油对超氧阴离子的半抑制浓度为150 ug/mL。丁香花蕾油和丁香酚都表现出较高的清除活性。当丁香花蕾油的浓度为0.8-38μg/mL时,其清除活性为8.7%-80.9%, 在相同浓度范围内,丁香酚的清除率为9.7%-89.6%。丁香花蕾油和丁香酚的半抑制率分别为8.5 μg/mL和7.7 μg/ mL。丁香花蕾油的浓度为10 ug/mL、30 μg/mL、60 μg/ mL时,超氧阴离子的清除能力为29.8%, 41.5%, 50.5%, 而对于相同浓度的丁香酚,其对超氧阴离子的清除能力分别为20.4%, 25.3%, 30.8%。丁香花蕾油的对超氧阴离子的半抑制浓度为58 ug. / mL。三种挥发油中丁香花蕾油对ABTS阳离子的清除能力最强,而其主要成分丁香酚对ABTS阳离子的清除能力更强,从而说明丁香花蕾油及其主要成分丁香酚有较强的抗氧化能力,与相关文献报道一致[46,47]。 而山苍子油对超氧阴离子的清除能力最强,说明山苍子油也具有较强的抗氧化能力。在脂质过氧化的抑制作用方面,丁香花蕾油、香茅油、丁香酚、香茅醛都具有抗脂质过氧化的作用,并且随着剂量的增加,抗氧化活性逐渐增强。丁香花蕾油和丁香酚的抗氧化能力强于香茅油和香茅醛。而山苍子油几乎没有抗脂质过氧化的能力。
蛋白质硝化是蛋白质氧化的一一种特殊形式,两者都是非常重要的蛋白质翻译后修饰,它们对蛋白质的功能产生非常重要的影响。而纳米二氧化钛在防晒产品中的广泛应用,紫外线的照射和皮肤表面汗液蒸发产生的亚硝酸盐为蛋白质的氧化和酪氨酸的硝化提供了充足的条件。本章研究了山苍子油、香茅油、丁香花蕾油对UVTiO2 - NO2催化的蛋白质硝化和蛋白质氧化的抑制作用,发现当LCEO或柠檬醛的浓度为0.01mg/mL时能够抑制蛋白质氧化,柠檬醛的抑制蛋白质氧化的能力强于LCEO,并且抑制能力呈剂量相关性。而对于抑制蛋白质的硝化,仅当LCEO和柠檬醛的浓度达到0.1 mg/ mL时才表现出较强的抑制蛋白质硝化的能力。当丁香花蕾油、丁香酚、香茅油、香茅醛以最低浓度0.01 mg / mL进行加样时,都具有抑制蛋白质氧化的能力。当加样浓度增加到0.1 mg/mL时,每种样品均具有较好的抗氧化能力。丁香花蕾油、香茅油、香茅醛表现出相似的保护作用,但在相同浓度下其抗氧化活性弱于丁香酚。对于蛋白质硝化的抑制作用方面,当丁香花蕾油和丁香酚的浓度为0.01mg/m时,能够完全抑制硝化的产生。而香茅油和其主要成分香茅醛仅在高浓度0.1mg/m 时,表现出一定的抑制蛋白质硝化的能力。
4.5 本章小结
在本章中,通过山苍子油、香茅油、丁香花蕾油体外清除ABTS和超氧阴离子实验,研究三种精油的抗氧化能力。我们发现丁香花蕾油及其主要成分丁香酚具有较强的清除ABTS*的能力,山苍子油和其主要成分柠檬醛具有较强的清除超氧阴离子的能力。丁香花蕾油、香茅油、丁香酚、香茅醛都具有抗脂质过氧化的作用,并且随着剂量的增加,抗氧化活性逐渐增强。丁香花蕾油和丁香酚的抗氧化能力强于香茅油和香茅醛。而山苍子油几乎没有抗脂质过氧化的能力。丁香花蕾油、丁香酚、香茅油、香茅醛、山苍子油、柠檬醛均具有较强的抑制蛋白质氧化的能力,其中丁香酚的抑制蛋白质氧化的能力最强。丁香花蕾油和丁香酚具有很强的抑制酪氨酸硝化的能力,山苍子油、柠檬醛、香茅油、香茅醛仅在较高浓度时表现出较强的抑制蛋白质硝化的能力。
4.6参考文献
[1] 涂国荣,张利兴,苏昆.自由基与皮肤衰老的关系及天然抗衰老植物在化妆品中的应用,日用化学品科学,1999,8:82-85
[2] Singh HP, Mittal S, Kaur S, et al. Characterization and antioxidant activity of essential oils from fresh and decaying leaves of Eucalyptus tereticornis. Journal of Agricultural and Food Chemistry, 2009, 57(15):6962-6966
[3] Edris AE. Pharmaceutical and therapeutic potentials of essential oils and their individual volatile constituents: a review. Phytotherapy Research, 2007, 21(4):308-323
[4]LuN,LiX,Li
J. Ntrative and oxidative modifications of enolase are
associated with iron in iron-overload rats and in vitro. Journal of Biological
Inorganic Chemistry, 2011, 16(3):481-490
[5] Aidi Wannes W, Mhamdi B, Sriti J, et al. Antioxidant activities of the essential
oils and methanol extracts from myrtle (Myrtus communis var. italica L.) leaf,
stem and flower. Food and Chemical Toxicology, 2010, 48(5):1362-1370
[6] Kilani S, Ledauphin J, Bouhlel I, et al. Comparative study of Cyperus rotundus essential oil by a modified GC/MS analysis method. Evaluation of its antioxidant, cytotoxic, and apoptotic effects. Chemistry & Biodiversity, 2008, 5(5):729-742
[7] Mechergui K, Coelho JA, Serra MC, et al. Essential oils of Origanum vulgare L. subsp. glandulosum (Desf.) letswaart from Tunisia: chemical composition and antioxidant activity. Journal of the Science of Food and Agriculture, 2010, 90(10):1745-1749
[8] Sutthanont N, Choochote W, Tuetun B. Chemical composition and larvicidal activity of edible plant-derived essential oils against the pyrethroid-susceptible and -resistant strains of Aedes aegypit(Diptera:Culicidae). Journal of Vector Ecology, 2010, 35:106-115
[9] Panich U, Kongtaphan K, Onkoksoong T. Modulation of antioxidant defense by Alpinia galangal and curcuma aromatica extracts correlates with their inhibition of UVA-induced melanogenesis. Cell Biology Toxicology, 2010, 26:103-116
[10] Panich U, Tangsupa a-nan V, Onkoksoong T, et al. Inhibition of UV A -mediated melanogenesis by ascorbic acid through modulation of antioxidant defense and nitric oxide system. Archives of Pharmacal Research, 201 1, 34(5):811-820
[11] Burnett ME, Wang SQ. Current sunscreen controversies: a critical review.
Photodermatology, photoimmunology & photomedicine, 2011, 27(2):58-67
[12] Tyner K, Wokovich A, Godar D, et al. The state of nano-sized titanium dioxide
(TiO2) may affect sunscreen performance. International Journal of Cosmetic Science, 201 1,33(3):234-244
[13] Kiss B, Biro T, Czifra G, et al. Investigation of micronized titanium dioxide penetration in human skin xenografts and its effect on cellular functions of human skin-derived cells. Experimental dermatology, 2008, 17(8):659-667
[14] Shen B, Scaiano,English A. Zeolite encapsulation decreases TiO2-photosensitized ROS generation in cultured human skin fibroblastst. Photochemistry and Photobiology, 2006, 82(1): 5-12
[15] Paunel AN, Dejam A, Thelen S, et al. Enzyme-independent nitric oxide formation during UVA challenge of human skin: characterization, molecular sources, and mechanisms. Free Radical Biology and Medicine, 2005, 38(5):606-615
[16] Oplander C, Cortese M, Korth H. The impact of nitrite and antioxidants on ultraviolet-A-induced cell death of human skin fibroblasts. Free Radical Biology Medicine, 2007, 43(5):8 18-829
[17] Weller R, Pattullo S, Smith L, et al. Nitric oxide is generated on the skin surface by reduction of sweat nitrate. Journal of Investigative Dermatology, 1996, 107(3):327-331.
[18] Re R, Pellegrini N, Proteggente A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology Medicine, 1999, 26(9-10):1231-1237
[19] Gao Z, Xu H, Chen X, et al. Antioxidant status and mineral contents in tissues of rutin and baicalin fed rats. Life Sciences, 2003, 73( 12):1599- 1607
[20] Mihara M, Uchiyama M. Determination of malonaldehyde precursor in tissues by thio barbituric acid test. Analytical Biochemistry, 1978, 86(1):271-278
[21] Hermes-Lima M, Willmore WG, Storey K B. Quantification of lipid peroxidation in tissue extracts based on Fe (II) xylenol orange complex formation. Free Radical Biology and Medicine, 1995,19(3):271-280
[22] Lu N, Zhu Z, Zhao X, et al. Nano titanium dioxide photocatalytic protein tyrosine nitration: A potential hazard of TiO2 on skin. Biochemical and Biophysical
Research Communications, 2008, 370(4):675-680
[23] Sapkota K, Park SE, Kim JE, et al. Antioxidant and anti melanogenic properties of chestnut flower extract. Bioscience, Biotechnology, and Biochemistry, 2010,
74(8):1527-1533
[24] Khazaeli P, Goldoozian
R, Shariffar F. An evaluation of extracts of five
traditional medicinal plants from Iran on the inhibition of mushroom tyrosinase
activity and scavenging of free radicals. International Journal of Cosmetic
Science, 2009, 31(5):375-381
[25] Beal MF. Oxidatively modified proteins in aging and disease. Free Radical Biology and Medicine, 2002, 32(9):797-803
[26] Gutteridge J, Richmond R, Halliwell B. Oxygen free-radicals and lipid peroxidation: Inhibition by theprotein caeruloplasmin. FEBS letters, 1980, 112(1): 269-272
[27] Lagouri V, Blekas G, Tsimidou M, et al. Composition and antioxidant activity of essential oils from oregano plants grown wild in Greece. Zeit schrift fir Lebensmitteluntersuchung und Forschung A, 1993, 197(1):20-23
[28] Lagouri V, Boskou D. Screening for antioxidant activity of essential oils obtained from spices. Developments in Food Science, 1995, 37(1):869-879
[29] Baratta MT, Dorman HJD, Deans SG, et al. Chemical composition, antimicrobial and antioxidative activity of laurel, sage, rosemary, oregano and coriander essential oils. Journal of Essential Oil Research, 1998, 10(6):618-627
[30] Farag R, Badei AZMA, Hewedi F, et al. Antioxidant activity of some spice essential oils on linoleic acid oxidation in aqueous media. Journal of the American Oil Chemists' Society, 1989, 66(6):792-799
[31] Maestri DM, Zygadlo JA, Lamarque AL, et al. Effect of some essential oils on oxidative stability of peanut oil. Grasas y aceites, 1996, 47(6):397-400
[32] Dang M, Takacsova M, Nguyen D, et al. Antioxidant activity of essential oils from various spices. Food/Nahrung, 2001, 45(1):64-66
[33] Saricoban C,Ozcan M. Antioxidative activity of rosemary (Rosmarinus officinalis L.) and sage (Salvia fruticosa L.) essential oils in chicken fat. Journal of Essential Oil Bearing Plants, 2004, 7(1):91-95
[34] Tepe B, Daferera D, Sokmen A. Antimicrobial and antioxidant activities of the essential oil and various extracts of Salvia tomentosa Miller (Lamiaceae). Food Chemistry, 2005, 90(3):333- -340
[35] Farag R, Ali M, Taha S. Use of some essential oils as natural preservatives for butter. Journal of the American Oil Chemists Society, 1990, 67(3):188-191
[36] Jukic M, Milos M. Catalytic oxidation and antioxidant properties of thyme essential oils (Thymus vulgare L). Croatica Chemical Acta, 2005,78(1):105-110
[37] Agar NS, Halliday GM, Barnetson RSC, et al. The basal layer in human squamous tumors harbors more UVA than UVB fingerprint mutations: a role for UVA in human skin carcinogenesis. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(14):4954-4959
[38] Ryu BM, Qian ZJ, Kim MM, et al. Anti-photoaging activity and inhibition of matrix metalloproteinase (MMP) by marine red alga, Corallina pilulifera methanol extract. Radiation Physics and Chemistry, 2009, 78(2):98- 105
[39] Kondo S. The roles of cytokines in photoaging. Jourmal of Dermatological Science, 2000, 23(1):30-36
[40] Rittie L, Fisher GJ. UV-light-induced signal cascades and skin aging. Ageing Research Reviews, 2002, 1(4):705-720
[41] Kehrer JP. Free radicals as mediators of tissue injury and disease. Critical Reviews in Toxicology, 1993, 23(1):21-48
[42] Aruoma O. Nutrition and health aspects of free radicals and antioxidants. Food and Chemical Toxicology, 1994, 32(7):671-683
[43] Fiers W, Beyaert R, Declercq W, et al. More than one way to die: apoptosis, necrosis and reactive oxygen damage. Oncogene, 1999, 18(54):7719-7730
[44] Record IR, Dreosti IE, Konstantinopoulos M, et al. The influence of topical and systemic vitamin E on ultraviolet light-induced skin damage in Hairless Mice. Nutrition and Cancer, 1991,16(3):219-225
[45] Kawaguchi Y, Tanaka H, Okada T, et al. The effects of ultraviolet A and reactive oxygen species on the mRNA expression of 72-kDa type IV collagenase and its tissue inhibitor in cultured human dermal fibroblasts. Archives of Dermatological Research, 1996,288( 1):39-44
[46] Ogata M, Hoshi M, Urano S, et al. Antioxidant activity of eugenol and related monomeric and dimeric compounds. Chemical and Pharmaceutical Bulletin-tokyo, 2000, 48( 10): 1467-1469
[47] Guan W, LiS, Yan R, et al. Comparison of essential oils of clove buds extracted with supercritical carbon dioxide and other three traditional extraction methods. Food Chemistry, 2007, 101(4):1558-1564
5全文总结
挥发油是芳香植物的次生代谢产物,安全性高,生物活性强。本文首先优化了水.蒸气蒸馏法提取山苍子油、丁香花蕾油、香茅油的条件,并在优化条件下,提取了三种挥发油,然后用GC-MS法分析了三种挥发油的成分;探讨了山苍子油、丁香花蕾油、香茅油及其主要成分柠檬醛、柠檬烯、芳樟醇、月桂烯、松油醇、丁香酚、乙酸丁香酯、β -石竹烯、香茅醛、香叶醇、香茅醇与酪氨酸酶活性的关系,并研究了山苍子油的主要成分柠檬醛对酪氨酸酶的抑制类型;测定了山苍子油、丁香花蕾油、香茅油和其主要成分柠檬醛、丁 香酚、香茅醛对ABTS阳离子和超氧阴离子自由基的清除能力,研究了丁香花蕾油、香茅油和其主要成分柠檬醛、丁香酚、香茅醛对脂质过氧化的抑制作用;考查了山苍子油、丁香花蕾油、香茅油和其主要成分柠檬醛、丁香酚、香茅醛对UV - TiO2- NO2引起的蛋白质氧化和硝化抑制作用。
5.1本论文的主要研究成果
(1)运用水蒸气蒸馏法萃取的自然晾干的山苍子果实的挥发油呈淡黄色。GC-MS分析水蒸气蒸馏法提取的山苍子油鉴定出19种化学成分,占总油的92.4%。其主要成分柠檬醛的相对含量占57.4%, 柠檬烯的含量占8.1%, 芳樟醇的含量为5.2%,β- 月桂烯的相对含量为4.7%, a-松油醇的相对含量为3.9%,β- 蒎烯的相对含量为2.7%, a -蒎烯的相对含量为1.9%。 同样用GC-MS分析产于中国广东的丁香花蕾油,鉴定出10 种物质,占总油的94.8%。 主要成分丁香酚的相对含量为76.8%,乙酸丁香酯的相对含量为9.5%,β-石竹烯的相对含量为6.0%。GC_MS分析的香茅叶的挥发油鉴定出17 种成分,占总油的93.5%。 其中
主要成分香茅醛的相对含量为33.9% 、香叶醇的相对含量为18.1% 、香茅醇的相对含量为11.1%
(2)通过酪氨酸酶抑制试验来评价三种挥发油及其主要成分对酪氨酸酶的抑制效果。结果表明山苍子油和其主要成分柠檬醛对酪氨酸酶单酚酶和二酚酶活性有抑制能力,对酪氨酸酶二酚酶的抑制能力强于酪氨酸酶单酚酶,且动力学结果表明,柠檬醛对酪氨酸酶是非竞争性抑制作用。丁香花蕾油和丁香酚对酪氨酸酶单酚酶具有一定的抑制作用,但是对酪氨酸酶二酚酶没有表现出任何抑制作用。而香茅油及其主要成分对酪氨酸酶没有抑制作用。
(3)通过山苍子油、香茅油、丁香花蕾油体外清除ABTS阳离子和超氧阴离子实验,研究三种精油的抗氧化能力。发现丁香花蕾油及其主要成分丁香酚具有较强的清除ABTS阳离子的能力,山苍子油和其主要成分柠檬醛具有较强的清除超氧阴离子的能力。丁香花蕾油、香茅油、丁香酚、香茅醛都具有抗脂质过氧化的作用,并且随着剂量的增加,抗氧化活性逐渐增强。丁香花蕾油和丁香酚的抗氧化能力强于香茅油和香茅醛。而山苍子油几乎没有抗脂质过氧化的能力。丁香花蕾油、丁香酚、香茅油、香茅醛、山苍子油、柠檬醛均具有较强的抑制蛋白质氧化的能力,其中丁香酚的抑制蛋白质氧化的能力最强。丁香花蕾油和丁香酚具有很强的抑制酪氨酸硝化的能力,山苍子油、柠檬醛、香茅油、香茅醛仅在较高浓度时表现出较强的抑制蛋白质硝化的能力。
5.2本论文创新之处
(1)以挥发油这种具有多重生物活性的天然产物为研究对象,结合GC-MS分析结果,从整体上研究挥发油的生物活性,然后深入研究挥发油中起主要的作用的化学成分,从而全面探讨挥发油的活性机理。
(2)同时探讨挥发油对酪氨酸酶的抑制作用和抗氧化作用。发现山苍子油及其主要成分柠檬醛具有较强的酪氨酸酶抑制活性和清除自由基的能力,说明山苍子油在化妆品领域具有皮肤美白和预防皮肤衰老的作用,在食品领域具有防止食品褐变和氧化变质的作用。
(3)选择UV- TiO2- NO2体系作为引起蛋白质氧化和硝化的模型,而这种模型是最为接近因使用化妆品导致的皮肤中蛋白质发生氧化和硝化的模型。通过实验发现,丁香花蕾油、丁香酚、香茅油、香茅醛、山苍子油、柠檬醛均具有较强的抑制蛋白质氧化的能力,其中丁香酚的抑制蛋白质氧化的能力最强。丁香花蕾油和了香酚具有很强的抑制酪氨酸硝化的能力,山苍子油、柠檬醛、香茅油、香茅醛仅在较高浓度时表现出较强的抑制蛋白质硝化的能力。
本文献摘自华中科技大学黄晓伟博士学位论文,如若侵权,请告知删除。


