3.1 引言
酪氨酸酶是活性中心含有双核金属铜的氧化还原酶,是黑色素生物合成的关键酶[1]。组氨酸残基位于酪氨酸酶的内部,结合的铜离子为酪氨酸酶的活性位点[2.3]酪氨酸酶催化黑色素形成的前两步:L-酪氨酸羟化形成工-二羟苯丙氨酸(L-DOPA)和后续的联苯酚氧化为醌(L-多巴醌)[4-7]在催化反应过程中酪氨酸酶可以分为三种形态[8-10]:脱氧态(Edeoxy)、氧化态(Eoxy)和还原态(Emet)。还原型酶只具有二酚酶活性,氧化型酶同时具有酪氨酸羟化酶活性(即单酚酶活性)和多巴氧化酶活性(即二酚酶活性),而脱氧型酶能够结合氧分子。在酶促反应过程中,氧化型酶和还原型酶作用于底物的同时自身被还原成脱氧型,脱氧型酶能够结合一分子氧回到氧化状态,完成一个循环。酪酸酶二酚酶的活力就是酪氨酸酶在黑色素生成的第二步中表现出的活力。还原态的酶与L-DOPA 非共价结合形成醒,而还原态酶转化为脱态的酶的过程[11-12]。酪氨酸酶单酚酶活力通常被认为是酪氨酸酶在黑色素生成过程中第一步表现出来的活力,即 L-酪氨酸氧化成为L-DOPA 过程中表现出来的催化活性。但是实际上这·活力与酪氨酸酶氧化L-DOPA为醌的活力是同时表现的,所以研究学者通常将酪氨酸酶催化L-酪氨酸为L-DOPA,进一步催化为多巴醌的过程表现出来的酶活力称为单酚酶活力[11,13]。
在化妆品工业,越来越注重使用酪氨酸酶抑制剂来阻止黑色素的异常形成。酪氨酸酶抑制剂能够减少黑色素的合成,被用到化妆品中防止黑色素过度沉着,包括雀斑的形成。但是,只有极少数的美白剂被使用,典型的如曲酸和熊果苷,是目前商业上可以获得的。此外,有些美白剂的对细胞的高毒性、对氧和水的低稳定性导致其被限制使用。
在食品工业,胺类、氨基酸、肽类和蛋白质与醌(酶性褐变)之间的反应让食品在储藏或加工过程中容易变质。必须氨基酸的破坏、可消化性降低、蛋白水解酶和糖酵解酶的抑制是食品营养流失的主要原因。抗营养物质和毒性物质的产生会进一步降低食品的营养价值和安全性[14]。因此,建立多种阻止酶性褐变的方法至关重要。目前常用的防止褐变的方法有高压灭菌和短暂蒸煮的方法,这种传统的方法不可避免的造成营养物质的损失[15]。也有用微波技术来处理食品的方法,但是运用微波加热技术的最大限制因素是在使用微波的过程中会产生温度阶差[16]。酶的灭活需要高温处理,而低温是无法让酶完全失活。因此单纯使用微波加热技术无法让食物表面的酶完全失活。综合运用微波热水处理法能够在最终营养价值、食品重量、加工时间上有改进[17]。目前已经发现一些能够通过干扰酪氨酸酶介导的反应或者通过将醌类物质还原成酚来抑制食品的酶性褐变的化合物[18-20]。但是,因为这些化合物的气味、毒性和经济可行性使得真正能够在食品中运用的很少[21]。亚硫酸盐类物质曾经被广泛用于农业和海产品领域来防止酶性褐变,但由于其安全性问题被食品药品监督管理局禁用[22]。而食品工业中最多被运用的是维生素℃和柠酸[20,23]。但是他们防褐变的能力没有亚硫酸盐强,因为在还原酪氨酸酶形成的醌类物质的过程中维生素C会很快被消耗。4-已基间苯二酚在食品中的使用被认为是安全的,并且能够有效的防止新鲜的水果和水果干的褐变。但是,作为食品工业中使用的抑制剂,安全性是首要考虑的问题。因此,不断寻找天然来源的没有副作用的抑制剂意义重大。
综上所述,开发出一系列安全性高、能够广泛应用于食品及化妆品领域的酪氨酸酶抑制剂具有重要意义。本章以山苍子油、香茅油、丁香花蕾油为目标,研究其对酪氨酸酶的抑制活性,并对每种挥发油的主要成分做进一步酪氨酸酶抑制试验,确定挥发油中的活性成分。
3.2材料与方法
3.2.1试剂与仪器
3.2.1.1主要试剂
蘑菇酪氨酸酶、L-DOPA、曲酸: .上海华蓝试剂有限公司;柠檬醛、柠檬烯、芳樟醇、β-月桂烯、a-松油醇、a-蒎烯、β-蒎烯、丁香酚、乙酸丁香酯、香茅醛、香叶醇、香茅醇:阿拉丁T试剂公司; L -酪氨酸:国药集团化学试剂有限公二甲亚砜(DMSO)及其它化学试剂均为分析纯。试验用纯水均为18.2M9纯水。
3.2.1.2主要试验仪器设备
Milli-Q Synthesis超纯水系统:美国Millipore 公司;RT-6000酶标仪:深圳雷杜生命科学股份有限公司。
3.2.2酪氨酸酶抑制试验
首先将山苍子油、香茅油、丁香花蕾油和标准品(柠檬醛、柠檬烯、芳樟醇、β-月桂烯、a.-松油醇、a.-蒎烯、β-蒎烯、丁香酚、乙酸丁香酯、香茅醛、香叶醇、香茅醇)分别溶于DMSO,随后用磷酸盐缓冲溶液稀释至适当的浓度作为测试样品。
酪氨酸酶二酚酶活性的测定:按照之前文献报道的方法[24-28]并做适当的修改。L-DOPA作为酪氨酸酶活性测定的底物。500 μL pH 6.8的磷酸盐缓冲溶液,150 μL2.5mM L-DOPA,50 μL不同浓度的受试样品混合均匀,25°C孵育10分钟。然后加入25 μL蘑菇酪氨酸酶(1380U/mL)。25°C孵育10分钟后,立即测其在475nm处的吸光度值。曲酸作为阳性对照。试验重复3次,数据取平均值。
单酚酶活力的测定:先将300 μuL 3mmol/L的L-酪氨酸溶液与100 μuL磷酸盐缓冲液(pH6.8) 充分混匀,50 μL不同浓度的受试样品混合均匀,于30°C 水浴中温浴10 min后,加入100 μL蘑菇酪氨酸酶( 1380U/ mL)。25°C孵育10分钟后,立即在475 nm处测定吸光度值。曲酸作为阳性对照。试验重复3次,数据取平均值。
酪氨酸酶抑制率的计算:
Inhibition (%) = (Arest smple - Abank)/ Acontrol x 100
其中Acotol为混合液添加了酪氨酸酶而没有加入受试样品的吸光度值; Ablank为混合液加入受试样品但是没有加入酪氨酸酶的吸光度值; Atest sample是混合液加入了受试样品和酪氨酸酶后的吸光度值。
3.2.3柠檬醛抑制类型的测定
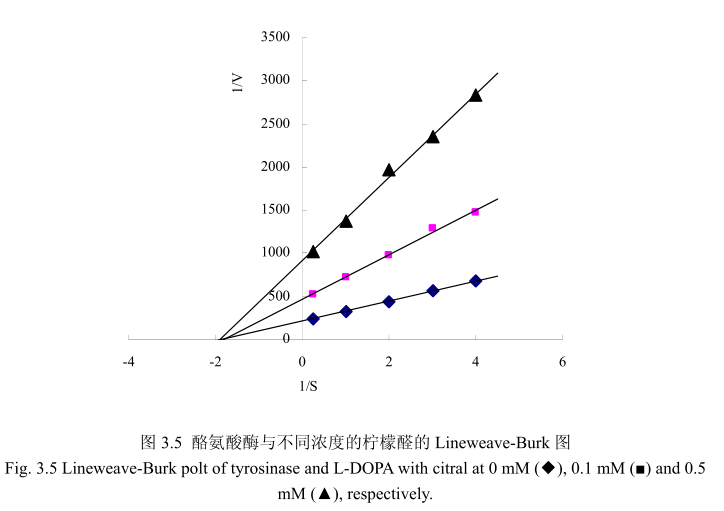
实验方法参照之前文献报道的方法并作适当修改[29, 30],不同浓度的L-DOPA(0.25 mM,0.333 mM,0.5 mM,1.0mM, 4.0 mM)作为底物, 825μL 磷酸盐缓冲溶液(pH6.8)加入75μL实验样品(0,0.1 mM, 0.5 mM),37.5μL 酪氨酸酶。用紫外分光光度计测475 nm处吸光值每分钟的增加量。酪氨酸酶活性的米氏常数Km和最大速度通过Lineweaver- _Burk plot来决定。
3.3实验结果
3.3.1丁香花蕾油与酪氨酸酶活性之间的关系
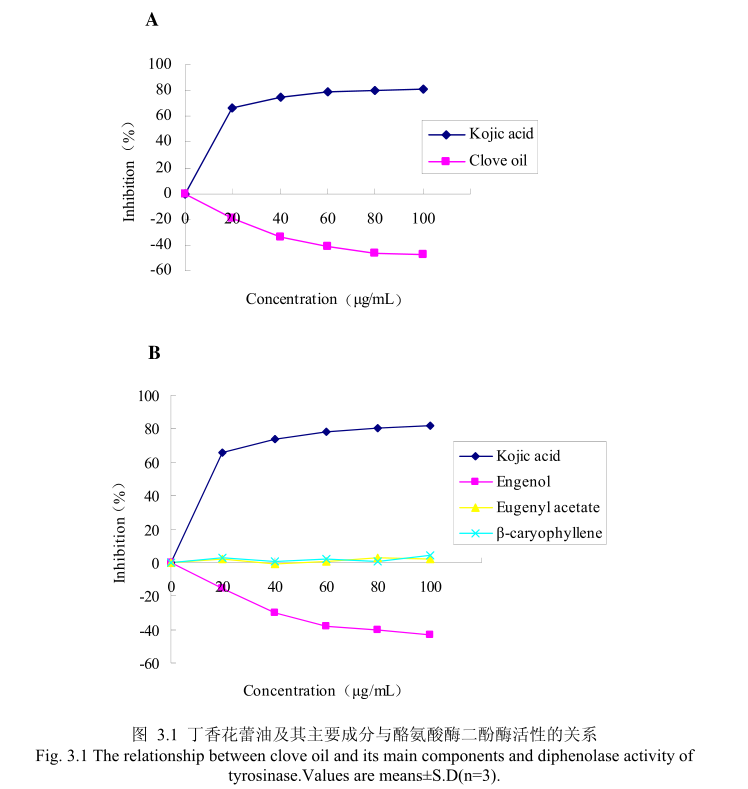
丁香花蕾油浓度与酪氨酸酶二酚酶活性之间的关系如图3.1A所示。我们选择具有强抑制酪氨酸酶活的曲酸为阳性对照,从图3.1A 我们可以看出,在曲酸浓度为0-20μg/m 时,随着曲酸浓度的增加,对酪氨酸酶二酚酶的活性有明显的抑制作用,抑制率达到 65.3%:当随着曲酸的浓度依次增高时,对酪氨酸酶二酚酶的抑制效率呈逐渐提升趋势,但增加的趋势较为缓慢,当曲酸浓度为100g/mL时,其对酪氨酸酶二酚酶的抑制率达到 76.1%。但丁香花蕾油对酪氨酸酶二酚酶的抑制率随其浓度的增加,抑制率呈负增长,表明丁香花蕾油对酪氨酸酶二酚酶没有明显的抑制作用。
为了进一步研究丁香花蕾油中的主要成分是否有抑制酪氨酸酶二酚酶酶活的能力,我们选取了丁香花蕾油中的三种主要成分,丁香酚、乙酸丁香酯和B-石竹烯,分别研究了他们的浓度和酪氨酸酶二酚酶抑制率之间的关系(图3.1B)。从图3.1B 中可以看出,丁香花蕾油主要成分丁香酚、乙酸丁香酯、B-石竹烯对酪氨酸酶二酚酶都没有明显的抑制能力。
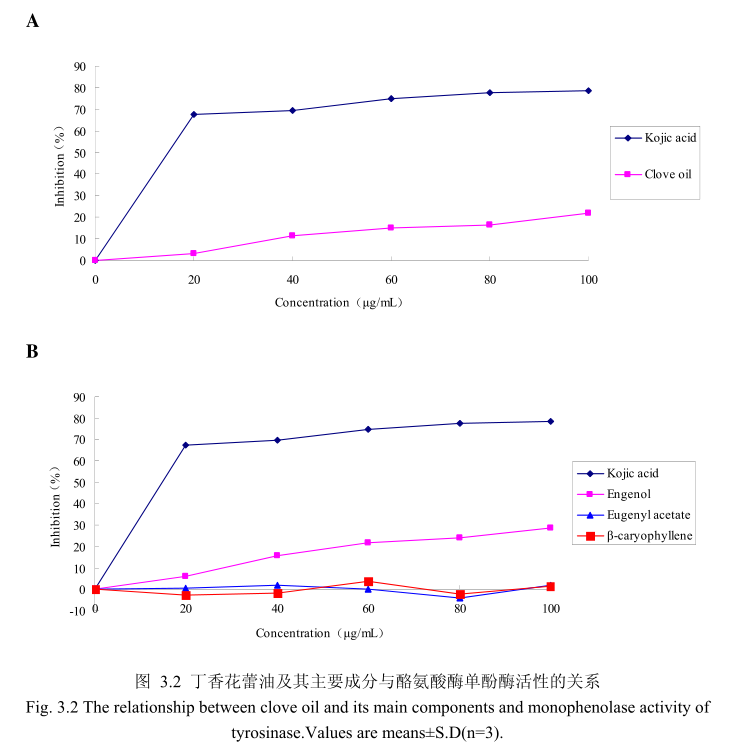
丁香花蕾油浓度与酪氨酸酶单酚酶活性之间的关系如图3.2A所示。我们选择具有强抑制酪氨酸酶活的曲酸为阳性对照,从图3.2A可以看出,在曲酸浓度为0-20μg/m 时,随着曲酸浓度的增加,对酪氨酸酶单酚酶活性有明显的抑制作用抑制率达到 70%;当随着曲酸的浓度依次增高时,对酪氨酸酶单酚酶的抑制率呈逐渐提升趋势,但增加的趋势较为缓慢,当曲酸浓度为100g/m时,其对酪氨酸酶单酚酶的抑制率达到 78.6%。丁香花蕾油对酪氨酸酶单酚酶的抑制率随其浓度的增加而增加,但是增加较为缓慢,当丁香花蕾油的浓度为100g/mL时,抑制率为 21.9%,表明丁香花蕾油对酪氨酸酶单酚酶活性有一定的抑制作用,但是曲酸对酪氨酸酶单酚酶活性的抑制作用强于丁香花蕾油。
为了进一步研究丁香花蕾油中的主要成分是否有抑制酪氨酸单酚酶的能力,我们选取了丁香花蕾油中的三种主要成分,丁香酚、乙酸丁香酯和B-石竹烯,分别研究了他们的浓度和酪氨酸酶单酚酶抑制率之间的关系(图3.2B)。从图3.2B中可以看出,丁香花蕾油主要成分丁香酚具有一定的抑制酪氨酸酶单酚酶活性的能力,当丁香酚的浓度为40μg/m 时,对酪氨酸酶单酚酶抑制率为16%,随着丁香酚的浓度逐渐增加,丁香酚对酪氨酸酶单酚酶的活性抑制作用逐渐增强,当丁香酚的浓度为 100g/m 时,丁香酚对酪氨酸酶单酚酶的活性的抑制率为28.6%。抑制作用比同样浓度下丁香花蕾油略强,但是比曲酸的的抑制作用弱。而丁香花蕾油的主要成分乙酸丁香酯、B-石竹烯对酪氨酸酶单酚酶都没有明显的抑制能力。
3.3.2 山苍子油与酪氨酸酶之间的关系
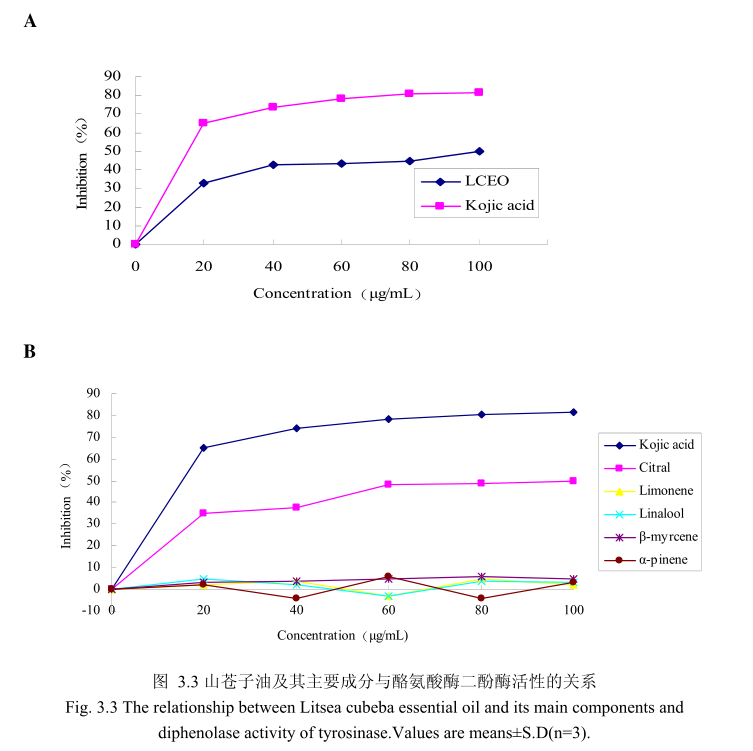
山苍子油浓度与酪氨酸酶二酚酶活性之间的关系如图3.3A 所示。我们选择具有强抑制酪氨酸酶活的曲酸为阳性对照,从图3.3A可以看出,在曲酸浓度为0-20Hg/m 时,随着曲酸浓度的增加,对酪氨酸酶二酚酶的活性有明显的抑制作用,抑制率达到 65.3%;当随着曲酸的浓度依次增高时,对酪氨酸酶二酚酶的抑制效率呈逐渐提升趋势,但增加的趋势较为缓慢,当曲酸浓度为100g/m时,其对酪氨酸酶二酚酶的抑制率达到 76.1%。山苍子油对酪氨酸酶二酚酶活性亦有明显的抑制作用,当浓度为0-20μg/m时,随着山苍子油浓度的增加,对酪氨酸酶二酚酶活性有明显的抑制作用,抑制率达到32%;当随着山苍子油的浓度依次增高时,对酪氨酸酶二酚酶活性的抑制率呈逐渐提升的趋势,但增加趋势较为缓慢,当山苍子油的浓度为100g/m 时,其对酪氨酸酶二酚酶的抑制率达到50%。因此,对照样品曲酸和山苍子油都对酪氨酸酶二酚酶的活性有较好的抑制作用,但是曲酸对酪氨酸酶二酚酶的抑制作用强于山苍子油。
为进一步研究山苍子油中的主要成分是否具有抑制酪氨酸酶二酚酶活性的能力,我们选取了山苍子油中的五种主要成分柠檬醛、柠檬烯、芳樟醇、月桂烯、松油醇,分别研究了他们的浓度和酪氨酸酶二酚酶抑制率之间的关系(图3.3B)。从图3.3B中可以看出,山苍子油主要成分柠醛对酪氨酸酶二酚酶活性具有较好的抑制能力,柠檬醛的浓度为 100μg/m 时,对酪氨酸酶二酚酶的抑制率达到 48%。而柠檬烯、芳樟醇、月桂烯、松油醇并没有表现出明显的对酪氨酸酶二酚酶的抑制作用。
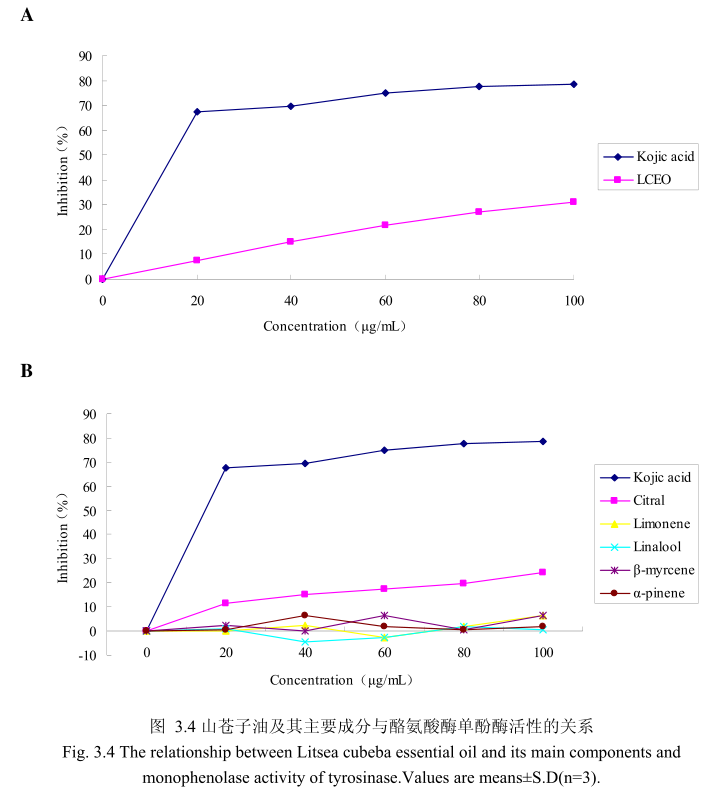
山苍子油浓度与酪氨酸酶单酚酶活性之间的关系如图3.4A所示。选择具有强抑制酪氨酸酶活性的曲酸为阳性对照。从图3.4A可以看出,在曲酸浓度为0-20μg/m 时,随着曲酸浓度的增加,对酪氨酸酶单酚酶的活性有明显的抑制作用,抑制率达到 67.4%;当随着曲酸的浓度依次增高时,对酪氨酸酶单酚酶的抑制率呈逐渐提升趋势,但增加的趋势较为缓慢,当曲酸浓度为100g/m时,其对酪氨酸酶单酚酶的抑制率达到 78.6%。山苍子油对酪氨酸酶单酚酶活性亦有一定的抑制作用,当浓度为0-20μg/mL 时,随着山苍子油浓度的增加,对酪氨酸酶单酚酶活性有一定的抑制作用,抑制率为7.6%;当随着山苍子油的浓度依次增高时,对酪氨酸酶单酚酶的抑制率呈逐渐提升的趋势,但增加趋势较为缓慢,当山苍子油的浓度为100g/m 时,其对酪氨酸酶单酚酶的抑制率达到31%。因此,对照样品曲酸对酪氨酸酶单酚酶的活性有较好的抑制作用,山苍子油对酪氨酸酶单酚酶具有一定的抑制作用。
为进一步研究山苍子油中的主要成分是否具有抑制酪氨酸酶单酚酶的能力,我们选取了山苍子油中的五种主要成分柠檬醛、柠檬烯、芳樟醇、月桂烯、松油醇,分别研究了他们的浓度和酪氨酸酶单酚酶抑制率之间的关系(图3.4B)。从图3.4B中可以看出,山苍子油主要成分柠檬醛对酪氨酸酶单酚酶活性具有一定的抑制能力,柠檬醛的浓度为100μg/m 时,对酪氨酸酶的抑制率达到 24.1%。而柠檬烯、芳樟醇、月桂烯、松油醇并没有表现出明显的对酪氨酸酶单酚酶的抑制作用。
3.3.3 柠檬醛抑制类型的测定
酶的抑制作用的研究主要是研究酶的催化机制、酶的结构和功能以及阐明酶的代谢途径的基本手段,同时也可以为新药物的设计、开发以及相关新产品研发提供一定的理论依据。因此,对酶的抑制作用及类型的研究具有重要的价值和理论意义如果抑制剂对酶的抑制作用是可逆的,即抑制剂与酶以非共价键的形式结合而引起酶的活力降低甚至是丧失,能够通过物理方法将抑制剂除去而让酶恢复活性,我们称之为可逆抑制;如果抑制剂对酶的抑制作用是不可逆的,即抑制剂与酶的必须基团以共价键的形式结合而引起酶失活,运用透析、超滤等物理方法不能将抑制剂去除而引起的酶活力丧失,我将其称之为不可逆抑制。可逆抑制作用可以根据抑制剂、底物和酶之间的关系而分为非竞争性抑制、反竞争性抑制和竞争性抑制。在非竞争性抑制过程中,抑制剂和底物能够同时和酶结合,两者之间没有竞争作用。酶与底物结合后还可以与抑制剂结合,同时酶与抑制剂结合后也可以与底物结合。但是这种由酶、抑制剂、底物结合而成的三元复合物不能够进一步分解为产物,因此会导致酶的活力降低。这种类型的抑制剂与酶的活性部位以外的基团相结合,其结构与底物没有相同的地方,这种类型的抑制作用不能通过增加底物浓度来解除抑制,所以称之为非竞争性抑制。在结构上,大多数的竞争性抑制剂与底物具有相似性,因此能够与酶的活性位点结合,与酶能够形成可逆的复合物,但是这种复合物不能够分解为产物,导致酶的反应速度下降。竞争性抑制剂的抑制程度取决于底物及抑制剂的相对浓度,这种抑制作用可以通过增加底物浓度而解除31。本节通过Lineweaver-Burk polts 分析抑制动力学,从而判断柠檬醛对酪氨酸酶抑制 L-DOPA氧化的机制。从图3.5可以看出,三条线分别代表不同浓度(0mM(◆),0.1mM(■),0.5 mM(▲))的柠檬醛,并且在 1/S 轴上相交于一点。结果表明柠檬醛是非竞争性抑制。结果与相关文献23报道一致。抑制剂柠檬醛与游离酶和酶底物复合物耦合醛类化合物如柠檬醛是蛋白质反应化合物,能够与生物学上重要的亲核基团基氨基或羟基反应。醛类能够与酪氨酸酶上的氨基形成席夫碱。不同醛类物质对酪氨酸酶的抑制活性的强弱取决于酪氨酸酶与醛类物质之间形成的席夫碱的稳定性。因此,可以认为酪氨酸酶抑制活性是由于柠檬醛与酪氨酸酶活性部位周围的亲核基团之间形成了席夫碱,形成了空间位阻阻碍酶与底物的结合,从而降低酶的活性。
3.3.4 香茅油与酪氨酸酶之间的关系
香茅油与酪氨酸酶二酚酶之间的关系如图3.6A所示。我们选择具有强抑制酪氨酸酶活性的曲酸为阳性对照。从图3.6A中可以看出,在曲酸浓度为0-20mg/mI时,随着曲酸浓度的增加,对酪氨酸酶二酚酶的活性有明显的抑制作用,抑制率达到 65.3%;当随着曲酸的浓度依次增高时,对酪氨酸酶二酚酶的抑制率呈逐渐提升趋势,但增加的趋势较为缓慢,当曲酸浓度为100g/m时,其对酪氨酸酶二酚酶的抑制率达到 76.1%。但是香茅油对酪氨酸酶二酚酶的抑制率随其浓度的增加,抑制率呈负增长,表明香茅油对酪氨酸酶二酚酶活性没有明显的抑制作用。
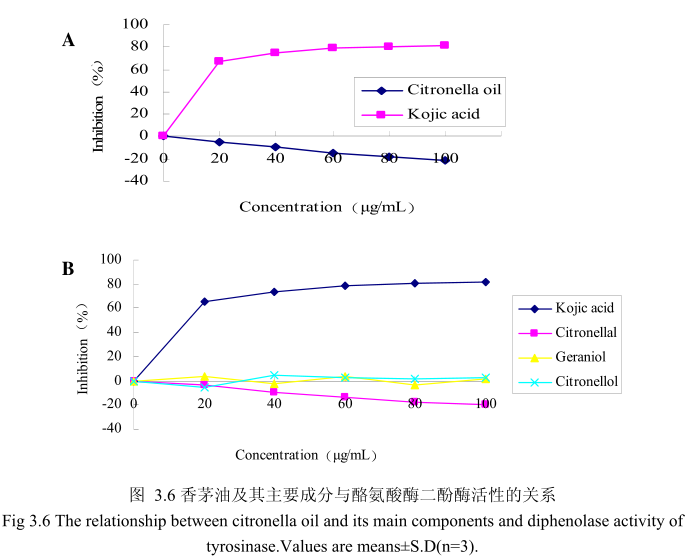
为了进一步研究香茅油中的主要成分是否有抑制酪氨酸酶二酚酶活性的能力,我们选取了香茅油中的三种主要成分,香茅醛、香叶醇和香茅醇,分别研究了他们的浓度和酪氨酸酶二酚酶抑制率之间的关系(图3.6B)。从图3.6B 中可以看出,香茅油主要成分香茅醛、香叶醇和香茅醇对酪氨酸酶二酚酶都没有明显的抑制能力。
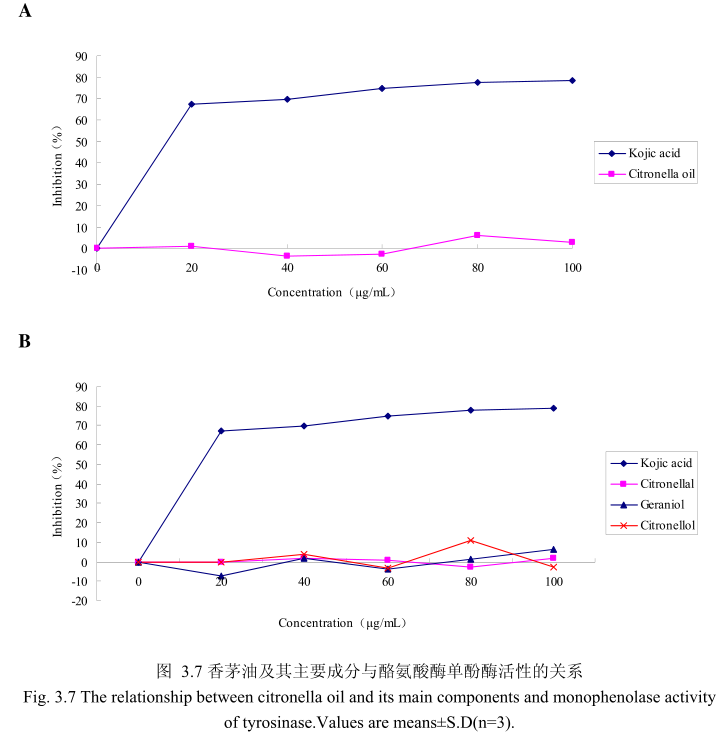
香茅油与酪氨酸酶单酚酶之间的关系如图3.7A所示。我们选择具有强抑制酪氨酸酶活的曲酸为阳性对照。从图3.7A中可以看出,在曲酸浓度为0-20g/mL时,随着曲酸浓度的增加,对酪氨酸酶单酚酶的活性有明显的抑制作用,抑制率达到 67.4%;当随着曲酸的浓度依次增高时,对酪氨酸酶单酚酶的抑制效率呈逐渐提升趋势,但增加的趋势较为缓慢,当曲酸浓度为100g/m时,其对酪氨酸酶单酚酶的抑制率达到 78.6%。但是香茅油对酪氨酸酶单酚酶活性的抑制率随其浓度的增加并没有明显的变化,表明香茅油对酪氨酸酶单酚酶活性没有明显的抑制作用。
为了进一步研究香茅油中的主要成分是否有抑制酪氨酸酶单酚酶活性的能力,我们选取了香茅油中的三种主要成分,香茅醛、香叶醇和香茅醇,分别研究了他们的浓度和酪氨酸酶抑制率之间的关系(图3.7B)。从图3.7B中可以看出,香茅油主要成分香茅醛、香叶醇和香茅醇对酪氨酸酶单酚酶都没有明显的抑制能力。
3.4 讨论
本章实验的主要目的是研究山苍子油、丁香花蕾油、香茅油对酪氨酸酶的抑制作用,并进一步探讨抑制机制。酪氨酸酶与人密切相关,是一种含有铜离子的酶通过两种不同的途径催化黑色素合成:通过酪氨酸酶羟化酪氨酸和氧化L-DOPA 为多巴配[32-34]。酪氨酸酶广泛存在于植物和动物中,参与黑色素的形成[35-37]。在食品工业,酪氨酸酶在控制食品和水果蔬菜的质量方面非常重要[36-38]。酪氨酸酶催化酚类物质氧化为对应的醌类,是水果和蔬菜酶性褐变的关键酶。此外,酶性褐变引起醌类物质与蛋白质上的氨基和巯基发生不可逆的反应,从而产生让人讨厌的颜色和气味。醌类物质与蛋白质的反应降低了蛋白质的可溶性和必须氨基酸的生物活性,包括赖氨酸和半胱氨酸。人类皮肤和头发的颜色取决于很多因素,最重要的就是黑色素的分布[39]。黑色素能够通过吸收紫外线和清除活性氧保护皮肤,但是黑色素的过度沉着如黑斑病、老年斑、雀斑常常影响美观。
挥发油通常具有明显的香气,常常用于香精的调配,广泛应用于食品和日化品中。同时,因为挥发油普遍具有抑制微生物生长的作用,能够作为天然防腐剂应用于食品及日化品中。而挥发油在养生保健方面,常常与植物油脂混合后直接用于皮肤按摩,不仅能够放松神经,更能起到养颜美容的功效。因此,如果挥发油能够作为酪氨酸酶抑制剂使用,将具有其它抑制剂所不具有的众多优势。
有相关文献报道丁香甲醇萃取物能够抑制B16黑素细胞中黑色素的形成[40]。丁香甲醇萃取物的主要活性物质为丁香酚和丁香乙酸酯,当浓度为100 μg/mL和200ug/mL时,对B16黑色素细胞中黑素的抑制率达到60%和40%。而丁香花蕾油同样含有丁香酚和丁香乙酸酯,当浓度为100μg/mL 和200 μg/mL时,对B16黑色素细胞中黑素的抑制率达到50%和80%。而本章实验中丁香花蕾油的主要成分为丁香酚和乙酸丁香酯,当其浓度均为100 μg/ mL时均没有表现出酪氨酸酶二酚酶抑制活性。丁香花蕾油对酪氨酸酶单酚酶的抑制率随其浓度的增加而增加,但是增加较为缓慢,当丁香花蕾油的浓度为100 ug / mL时,抑制率为219%,表明丁香花蕾油对酪氨酸酶单酚酶活性有一定的抑制作用。丁香花蕾油主要成分丁香酚具有一定的抑制酪氨酸酶单酚酶活性的能力,当丁香酚的浓度为40μg/ mL时,酪氨酸酶单酚酶抑制率为16%, 随着丁香酚的浓度逐渐增加,丁香酚对酪氨酸酶单酚酶的活性抑制作用逐渐增强,当丁香酚的浓度为100 μg/mL时,丁香酚对酪氨酸酶单酚酶活性的抑制率为28.6%。抑制作用比同样浓度下丁香花蕾油略强,但是比曲酸的抑制作用弱。而丁香花蕾油的其他主要成分如乙酸丁香酯、β-石竹烯对酪氨酸酶单酚酶都没有明显的抑制能力。体外实验与文献报道的细胞实验有一定的差异,可能是由于丁香花蕾油的酪氨酸酶抑制活性在体外实验环境和细胞实验环境中本身就存在差异。同时,由于体外实验环境是水溶性环境,丁 香花蕾油在水中的溶解度有限,如果当丁香花蕾油的浓度进--步增大,则表现出更强的酪氨酸酶抑制能力。
本实验中证明山苍子油及其主要成分柠檬醛对酪氨酸酶单酚酶和二酚酶活性均有抑制作用,与之前有文献报道柠檬油及其主要成分柠檬醛有酪氨酸酶抑制活性一致[29]。醛类是已知的与具有生物活性的亲核基团(如巯基、氨基、羟基)反应的重要基团,所以它的抑制活性是由于醛基可以与酪氨酸酶活性中心周围的氨基反应形成席夫碱,产生的空间位阻阻碍酶与底物的结合,从而酶活性降低。
鉴于试验中发现山苍子油的抑制效果要高于同等含量的柠檬醛,所以我们研究了山苍子油中主要成分对酪氨酸酶的抑制效果。从图3.3和3.4中可以看出,山苍子油对酪氨酸酶抑制的作用主要来自于柠檬醛,柠檬烯的作用很小,其他成分芳樟醇、松油醇、月桂烯在同等浓度下没有表现出对酪氨酸酶的抑制作用。可以推断,山苍子油所表现出对酪氨酸酶的抑制活性强于柠檬醛可能由于其他未知成分引起,也可能是由于在某种组分的协同作用下,使柠檬醛的抑制活性增强。
本章实验表明,香茅油及其主要成分香茅醛并没有表现出酪氨酸酶单酚酶和二酚酶的抑制活性。而香茅醛与柠檬醛有着相似的结构,并且醛类物质也可能与酪氨酸酶上的氨基形成席夫碱。但是香茅醛并没有表现出酪氨酸酶抑制活性,可能是由于香茅醛与酪氨酸酶.上的氨基形成的希夫碱稳定性比柠檬醛与酪氨酸酶上的氨基形成的席夫碱要弱。
3.5本章小结
本章主要探讨丁香花蕾油、山苍子油、香茅油对酪氨酸酶的抑制作用。通过实验发现,丁香花蕾油对酪氨酸酶二酚酶没有抑制作用,对酪氨酸酶单酚酶具有--定的抑制作用,当浓度为100 μg/mL时,抑制率为219%。丁香花蕾油的主要成分丁香酚、乙酸丁香酯、β-石竹烯对酪氨酸酶二酚酶没有抑制作用,但是J香酚对酪氨酸酶单酚酶具有- -定的抑制作用,当丁香酚的浓度为100 ug/mL时,丁香酚对酪氨酸酶单酚酶活性的抑制率为28.6%, 而乙酸丁香酯、β -石竹烯对酪氨酸酶单酚酶也没有表现出抑制作用。香茅油及其主要成分香茅醛、香叶醇、香茅醇对酪氨酸酶单酚酶和二酚酶均没有抑制作用。山苍子油对酪氨酸酶二酚酶有较好的抑制作用,当浓度为100 ug/ mL时对酪氨酸酶二酚酶活性的抑制率达到50%。山苍子油中的主要成分柠檬醛对酪氨酸酶二酚酶有抑制作用,当浓度为105μg/mL时对酪氨酸酶的活性抑制率达到50%,山苍子油中的其他主要成分柠檬烯、芳樟醇、月桂烯、松油醇并没有表现出明显的对酪氨酸酶__.酚酶的抑制作用。山苍子油对酪氨酸酶单酚酶活性亦有一定的抑制作用,当山苍子油的浓度为100 ug/mL时,其对酪氨酸酶单酚酶的抑制率达到31%。山苍子油中的主要成分柠檬醛对酪氨酸酶单酚酶活性具有一定的抑制能力,当柠檬醛的浓度为100 ug/ mL时,对酪氨酸酶单酚酶的抑制率达到24.1%。 而其他主要成分柠檬烯、芳樟醇、月桂烯、松油醇并没有表现出明显的对酪氨酸酶单酚酶的抑制作用。通过Lineweaver-Burk polts进一步分析柠檬醛的抑制类型,结果表明柠檬醛为非竞争性抑制。
3.6参考文献
[1] Kwon BS, Haq AK, Pomerantz SH, et al. Isolation and sequence of a cDNA clone for human tyrosinase that maps at the mouse c-albino locus. Proceedings of the National Academy of Sciences of the United States of America, 1987,84(21):7473- -7477
[2] Hearing VJ, Jimenez M. Mammalian tyrosinase - the critical regulatory control point in melanocyte pigmentation. International Journal of Biochemistry, 1987, 19(12):1141-1147
[3] Ito S, Wakamatsu K. Quantitative analysis of eumelanin and pheomelanin in humans, mice, and other animals: a comparative review. Pigment Cell Research, 2003, 16(5):523-531
[4] Prota G. The role of peroxidase in melanogenesis revisited. Pigment Cell Research, 1990,3:25-31
[5] Hearing V. Unraveling the melanocyte. American Journal of Human Genetics, 1993, 52(1):1-7
[6] Ito S, Fujita K, Takahashi H, et al. Characterization of melanogenesis in mouse and guinea pig hair by chemical analysis of melanins and of free and bound dopa and 5-S-cysteinyldopa. Journal of Investigative Dermatology, 1984, 83(1):12-14
[7] Strothkamp K, Jolley R, Mason H. Quaternary structure of mushroom tyrosinase. Biochemical and Biophysical Research Communications, 1976, 70(2):519-524
[8] 王芳.桑叶中酪氨酸酶抑制成分的研究.浙江工商大学博士学位论文.2008.
[9] Fenol LG, Rodriguez-Lopez JN, Garcia Sevilla F, et al. Analysis and interpretation of the action mechanism of mushroom tyrosinase on the monophenols and diphenols generating highly unstable O-quinones. Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology, 2001,1548:1-22
[10] Decker H, Terwilliger N. Cops and robbers:putative evolution of copper oxygen-binding proteins. The Journal of Experimental Biology, 2000, 203:1777-1782
[11]林敏, 抑制剂对蘑菇酪氨酸酶与马铃薯多酚氧化酶抑制效应的比较研究.厦门大学硕士学位论文.2007.
[12] Naish-Byfield S, Riley PA. Oxidation of monohydric phenol substrates by tyrosinase. Biochemistry, 1992, 288:63-67
[13] Espin JC. Kinetic characterization of the substrate specificity and mechanism of mushroom tyrosinase. Biochemistry, 2000, 267:1270-1279
[14] Bos C, Gandichon C, Tome D. Nutritional and physiological criteria in the assessment of milk protein quality for humans. Journal of the American College of Nutrition, 2000,19(2): 191-205
[15] Konanayakam M, Sastry S. Kinetics of shrinkage of mushrooms during blanching. Journal of Food Science, 1988, 53(5): 1406-1411
[16] Maskan M. Drying, shrinkage and rehydration charateristics of kiwifruits during hot air and microwave drying. Journal of Food Engineering , 2001 ,48(2):177-182
[17] Devece C, Rodriguez-Lopez JN, Fenoll LG, et al. Enzyme inactivation analysis for industrial blanching applications: comparison of microwave, conventional, and combination heat treatments on mushroom polyphenoloxidase activity. Journal of Agricultural and Food Chemistry, 1999, 47(11):4506-4511
[18] Langdon T. Preventing of browning in fresh prepared potatoes without the use of sulfiting agents. Food Technology, 1987, 41(5):64-67
[19] Dudley ED, Hotchkiss JH. Cysteine as an inhibitor of polyphenol oxidase.Journal of Food Biochemistry, 1989, 13( 1):65-75
[20] Santerre CR, Cash J, Vannorman D. Ascorbic acid/citric acid combinations in the processing of frozen apple slices. Journal of Food Science, 1988, 53(6): 1713-1716
[21] Kim YJ, Uyama H. Tyrosinase inhibitors from natural and synthetic source:structure, inhibitor mechanism and perspective for the future. Cellular and Molecular Life Sciences, 2005,62:1707-1723
[22] Chalom s, Elrezzi E, Pena P, et al. Composition of sulfited potatoes: comparision with fresh and frozen potatoes. Plant Foods for Human Nutrition, 1995,47:133-138
[23] Hsu A, Shieh J, Bills D, et al. Inhibition of mushroom polyphenoloxidase by ascorbic acid derivatives. Journal of Food Science, 1988, 53(3):765-767
[24] Yu LL, Hu WC, Ding G, et al. Gusanlungionosides A-D, Potential Tyrosinase Inhibitors from Arcangelisia gusanlung. Jourmal of Natural Products, 2011,74(5): 1009-1014
[25] Kubo I, Kinst-Hori I. Tyrosinase inhibitors from cumin. Journal of Agricultural and Food Chemistry, 1998, 46( 12):5338-5341
[26] Kubo I, Kinst-Hori I, Chaudhuri SK, et al. Flavonols from Heterotheca inuloides: tyrosinase inhibitory activity and structural criteria. Bioorganic & Medicinal Chemistry, 2000, 8(7):1749- 1755
[27] Kubo I, Kinst-Hori I. Tyrosinase inhibitory activity of the olive oil flavor compounds. Journal of Agricultural and Food Chemistry, 1999,47(11):4574-4578
[28] Kubo I, Kinst: Hori I. Tyrosinase inhibitors from anise oil. Journal of Agricultural and Food Chemistry, 1998, 46(4):1268-1271
[29] Matsuura R, Ukeda H, Sawamura M. Tyrosinase inhibitory activity of citrus essential oils. Journal of Agricultural and Food Chemistry, 2006, 54(6):2309-2313
[30] Ha YM, Chung SW, Song S, et al. 4-(6-Hydroxy-2-naphthyl)-1, 3-bezendiol: apotent, new tyrosinase inhibitor. Biological and Pharmaceutical Bulletin, 2007,
30(9):1711-1715
[31] 王镜岩,朱圣庚,徐长法.生物化学.第三版.高等教育出版社,2002.368-369
[32] Canovas FG, Garcia-Carmona F, Sanchez JV, et al. The role of pH in the melanin biosynthesis pathway. Journal of Biological Chemistry, 1982, 257(15):8738-8744
[33] Neptuno Rodriguez-Lopez J, Tudela J, Varon R, et al. Kinetic study on the effect of pH on the melanin biosynthesis pathway. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 1991, 1076(3):379-386
[34] Cooksey CJ, Garratt PJ, Land EJ, et al. Evidence of the indirect formation of the catecholic intermediate substrate responsible for the autoactivation kinetics of tyrosinase. Jourmal of Biological Chemistry, 1997,272(42):26226-26235
[35] Pawelek JM, Korner AM. The Biosynthesis of Mammalian Melanin: The regulation of pigment formation, the key to disorders such as albinism and piebaldism, may also offer some clues for the treatment of melanoma. American Scientist, 1982, 70(2):136-145
[36] Mayer AM. Polyphenol oxidases in plants -recent progress. Phytochemistry, 1986, 26(1):11-20
[37] Kocher A, Choct M, Hughes RJ, et al. Effect of food enzymes on utilisation of lupin carbohydrates by broilers. British Poultry Science, 2000,41(1):75-82
[38] Friedman M. Food browning and its prevention: an overview. Journal of Agricultural and Food Chemistry, 1996, 44(3):631-653
[39] Passeron T, Mantoux F, Ortonne JP. Genetic disorders of pigmentation. Clinics in Dermatology, 2005,23(1):56-67
[40] Arung ET, Matsubara E, Kusuma IW, et al. Inhibitory components from the buds of clove (Syzygium aromaticum) on melanin formation in B 16 melanoma cells. Fitoterapia, 2011, 82(2):198-202
未完待续……


