2.1 引言
挥发油是芳香植物中次生代谢形成的具有挥发性的天然混合物,具有强烈的香气。挥发油最初在中世纪由阿拉伯人通过水蒸气蒸馏获得。由于其具有杀菌、抗病毒、抑制微生物繁殖的特性,被用于食品保存、抗微生物、止痛、镇静、抗炎、解痉挛和局部麻醉。直至今天,这些性质并没有很大变化,只是在作用机制方面的研究更加深入,尤其是在抗微生物领域的研究。
在自然界,挥发油在保护植物方面有着重要的作用,如抗微生物、抗病毒、抗真菌、杀虫、降低食草动物的食欲。
挥发油为传统药典中的一个重要部分,外观为澄清液体,具有挥发性,通常密度小于水。所有的植物器官都能提取挥发油,如花蕾、花、叶、茎、小分支、种子果实、根、树干或树皮。提取挥发油的方法有多种,如超临界流体取、微波辅助萃取、水蒸气蒸馏、有机溶剂萃取。由于挥发油具有抗微生物和杀灭真菌的活性能够取代化学杀菌剂而在制药和食品领域得到越来越广泛的应用。在这种情况下,水蒸气蒸馏法和压榨法常被使用,如柑橘挥发油的提取。在香精领域,常常运用超临界流体萃取和水蒸气蒸馏法提取挥发油。提取的挥发油会因为植物的生长气候、土壤环境、植物器官、生长年龄和周期的不同而在挥发油含量、质量和化学成分上存在差异[1-2]。因此,为了获得成分基本一致的挥发油,通常选择植物的相同部位进行提取,且这些植物的土壤环境一样、生长气候一样、采摘季节一样。许多商品化的挥发油都要用气相色谱和质谱联用来分析成分。通过分析报告来保证挥发油的质量[3]
本章采用提取挥发油最常用的水蒸气蒸馏法,提取丁香花蕾油、香茅油、山苍子油,并用GC、GC-MS分析每种挥发油的成分,确定各种油的主要成分的相对含量。
2.2 材料和方法
2.2.1 主要原料及试剂
丁香花蕾:2009年采摘于中国广东,室温条件下自然风干;香茅:2009年采摘于中国广东,室温条件下自然风干;山苍子果实:2009年采摘于中国广东,室温条件下自然风干;无水硫酸钠(国药集团化学试剂有限公司);正构烷烃C8~C40(北京百灵威科技有限公司)。
2.2.2 主要仪器
气质联用仪(ThermoTrace GC/Ultra-DSQI );油水分离器(武汉大学科教仪器厂);气相色谱仪(Thermo Trace GC ULTRA);密度折光联用仪(Antonpaar股份有限公司);电热套(巩义市予华仪器有限公司)。
2.2.3 挥发油提取的单因素条件实验
山苍子挥发油提取单因素条件实验:选择优质的山苍子,提取的粒径选择未粉碎、粉碎至20目、粉碎至40目、粉碎至60目、粉碎至80目五个水平;浸泡时间分别采用0小时、2 小时、4 小时、6 小时、8 小时、10 小时和 12小时七个水平;料液比 1:4、1:6、1:8、1:10、1:12、1:14六个水平;提取时间为2小时、4小时、6 小时、8小时、10小时五个水平。分别进行单因素实验
丁香花蕾挥发油提取单因素条件实验:选择优质的丁香花蕾,提取的粒径选择未粉碎、粉碎至 20目、粉碎至40目、粉碎至60目、粉碎至80目五个水平;浸泡时间采用0小时、2 小时、4 小时、6 小时、8 小时、10 小时、12 小时七个水平;料液比 1:4、1:6、1:8、1:10、1:12、1:14 六个水平;提取时间为 2小时、4 小时、6 小时、8 小时、10 小时五个水平。分别进行单因素实验。
香茅叶挥发油提取单因素条件实验:选择优质的香茅叶,提取的粒径选择整叶、剪碎、粉碎至20目、粉碎至40目、粉碎至60目5个水平;浸泡时间采用0小时、2 小时、4 小时、6 小时、8 小时五个水平;料液比 1:4、1:6、1:8、1:10、1:12、1:14 六个水平;提取时间为 2 小时、4 小时、6 小时、8 小时、10小时五个水平。分别进行单因素实验。
挥发油得率(%)=挥发油质量(g)/提取原料质量(g)x100%
2.2.4 最优条件下水蒸气蒸馏法提取挥发油
三种植物挥发油的提取如文献报道[4.5],只做了少量的修改,具体如下所述:山苍子油:取山苍子果300克粉碎,过筛,放入挥发油提取装置,加入10倍质量的1%的氯化钠溶液,浸泡8小时后,水中蒸馏6小时,油水分离器中收集山苍子油。向山苍子油中加入适量的无水硫酸钠,静置2小时,过滤,得到的挥发油称重,然后在 4℃ 冷藏柜中密封避光保存待用。
丁香花蕾油:取丁香花蕾300克粉碎,过,放入挥发油提取装置,加入12倍质量的1%的氯化钠溶液,浸泡6小时后,水中蒸馏6小时,油水分离器中收集丁香花蕾油。向丁香花蕾油中加入适量的无水硫酸钠,静置2小时,过滤,得到的挥发油称重,然后在4℃冷藏柜中密封避光保存待用。
香茅油:取香茅叶300克粉碎,过,放入挥发油提取装置,加入8倍质量的1%的氯化钠溶液,浸泡4小时后,水中蒸馏4小时,油水分离器中收集香茅油。向香茅油中加入适量的无水硫酸钠,静置2小时,过滤,得到的挥发油称重,然后在4℃冷藏柜中密封避光保存待用。
2.2.5 挥发油成分分析
GC-MS 分析条件:
毛细管柱:HP5-MS(30mx0.25mmi.d.x0.25 um d.f);进样口温度:250℃;升温程序:起始柱温50℃ ,保持2min,5℃min 升温至250℃,保持15min;载气:He,流速 1.0mL/min;样品用无水乙醇稀释100倍;进样量:1μL,分流比 50:1;质谱接口温度:250℃:电离方式:EI:电离能量:70eV:离子源温度:250℃:质量扫描范围:41-350amu。采用Wiley和Nist谱检索、人工图谱解析以及查对质谱相关文献进行定性。正构烷烃C~C的混合标样用相同的分析条件分析来计算保留指数。
GC-FID 分析条件:
GC-FID分析条件与GC-MS相似,但是载气为氮气。挥发油各组分的相对含量在没有使用矫正因子的条件下通过GC-FID峰面积计算而来。
2.3 实验结果
2.3.1 水蒸气蒸馏法提取挥发油工艺优化
2.3.1.1 水蒸气蒸馏法提取山苍子挥发油工艺优化
2.3.1.1.1 不同提取粒径对山苍子挥发油得率的影响
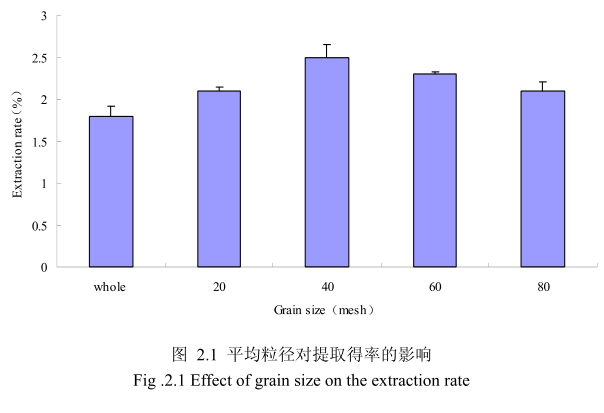
选择提取浸泡时间6小时、料液比1:8(质量比)、提取时间6小时、提取的粉碎粒径为未粉碎、粉碎至20目、粉碎至40目、粉碎至60目、粉碎至80目进行提取实验,实验结果如图2.1所示。从图中可以看出,当山苍子的提取粒径从未粉碎、粉碎至20目到粉碎至40目的过程中,山苍子油的得率随着粉碎粒径的变细而增大,当粉碎粒径为40目时,挥发油的得率最高。该过程中由于山苍子粉碎的越细,比表面积就越大,越有利于挥发油的浸出,所以挥发油的得率随着粉碎粒径的变小而增大。但是,当山苍子的粉碎粒径变为60目和80目时,山苍子油的得率反而下降。这可能是由于粉碎粒径的变小让颗粒比表面积增大的同时,颗粒自身的表面吸附作用增加,从而抑制了挥发油的扩散。同时,挥发油具有较强的挥发性,当粉碎粒径过细时,粉碎过程中会有少量的挥发油挥发损失掉,从而降低了挥发油的最终得率。因此,从本实验可以看出,山苍子的提取平均粒径控制在40目时挥发油的得率最高。
2.3.1.1.2 不同浸泡时间对山苍子挥发油得率的影响
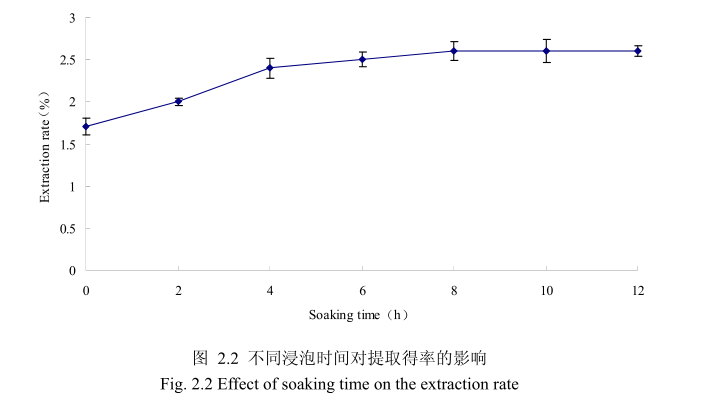
选择提取粒径为40目、料液比1:8(质量比)、提取时间6小时、提取的浸泡时间为0小时、2 小时、4 小时、6 小时、8 小时、10 小时、12 小时进行提取实验,从上图2.2可以看出,浸泡时间在0到8小时时间范围内,山苍子挥发油提取率随着浸泡时间的延长而增大。当浸泡时间为8小时,挥发油的得率达到较大值,随着浸泡时间的进一步延长,挥发油的得率几乎没有变化。造成这种现象的原因可能是由于浸泡过程可以使植物的细胞间隙增大,细胞组织充分膨胀,从而加速细胞内外的液体交换与平衡。由于山苍子质地较为坚硬,吸水性较差,因此需要浸泡较长时间才能让细胞组织充分膨胀。但是当浸泡达到一定时间后,细胞内外液体交换已经达到平衡,所以浸泡时间的进一步延长并不能改变精油的提取率。因此,选择浸泡时间为8小时时提取效率最高。
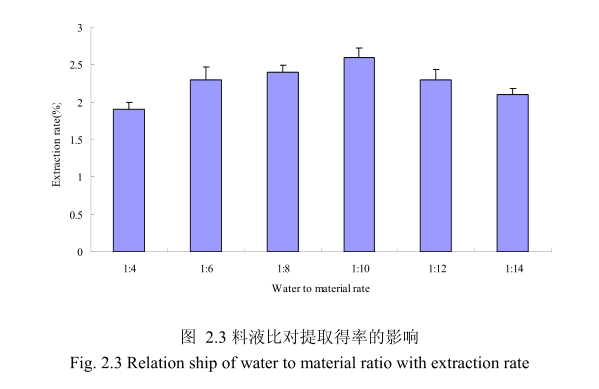
2.3.1.1.3 不同料液比对山苍子挥发油得率的影响
选择提取粒径40目,浸泡时间8小时,提取时间6小时,料液比为 1:4、1:6、1:8、1:10、1:12、1:14进行单因素实验。实验结果如图 2.3 所示,从图中可以发现,料液比从 1:4变化到1:10的过程中山苍子油的得率逐渐增加,料液比为1:10时山苍子油的得率最大。得率增加的原因可能是由于水的增多使山苍子中的山苍子油与水接触面处的浓度差变大,有利于山苍子油从组织中扩散出来。但当料液比从1:10 变化到 1:14 的过程中山苍子油的得率反而逐渐减少。可能由于水的增加,造成挥发油在水中的损耗增加,但是水量增加到一定程度对丁香花蕾油的扩散作用的影响已经不大,所以挥发油的得率降低。因此,当料液比为1:10时山苍子油的得率最高。
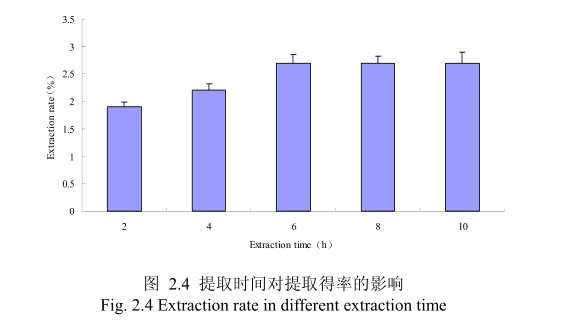
2.3.1.1.4 不同提取时间对山苍子挥发油得率的影响
选择提取粒径为40目、料液比1:10(质量比)、浸泡时间8小时、提取时间为2小时、4 小时、6 小时、8小时、10小时进行提取实验,从图 2.4 中可以看出随着提取时间的不断延长,山苍子油的得率显著提高,当提取时间达到6小时时,山苍子油的得率达到较大值,随着提取时间的进一步延长,山苍子油的得率并没有显著的变化。所以可以推测,当山苍子提取到6小时时,体系的渗透压达到平衡,提取率趋于恒定,随着加热时间的延长,挥发油的提取效率并不能提高。
2.3.1.2 水蒸气蒸馏法提取丁香花蕾挥发油工艺优化
2.3.1.2.1 不同提取粒径对丁香花蕾挥发油得率的影响
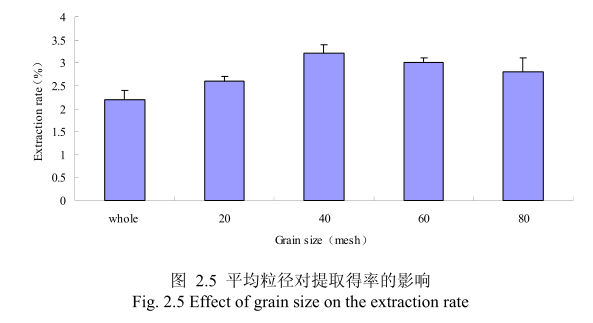
选择提取浸泡时间6小时、料液比1:8(质量比)、提取时间6小时、丁香花蕾的粉碎粒径分别为未粉碎、20目、40目、60目、80 目时进行提取实验,实验结果如图2.5所示。从图中可以看出,当丁香花蕾的提取粒径从未粉碎、粉碎至20目到粉碎至40目的过程中,丁香花蕾油的得率随着粒径的变细而增大,当粉碎粒径为 40目时,挥发油的得率最高。该过程中由于丁香花蕾粉碎的越细,比表面积就越大,越有利于挥发油的浸出,所以挥发油的得率随着粉碎粒径的变小而增大。但是,当丁香花蕾的粉碎粒径变为60目和80目时,丁香花蕾挥发油的得率反而下降。这可能是由于粉碎粒径的变小让颗粒比表面积增大的同时,颗粒自身的表面吸附作用增加,从而抑制了挥发油的扩散。同时,挥发油具有较强的挥发性当粉碎粒径过细时,粉碎过程中会有少量的挥发油挥发损失掉,从而降低了挥发油的最终得率。因此,从本实验可以看出,丁香花蕾的提取平均粒径控制在40目时挥发油的得率最高。
2.3.1.2.2 不同浸泡时间对丁香花蕾挥发油得率的影响
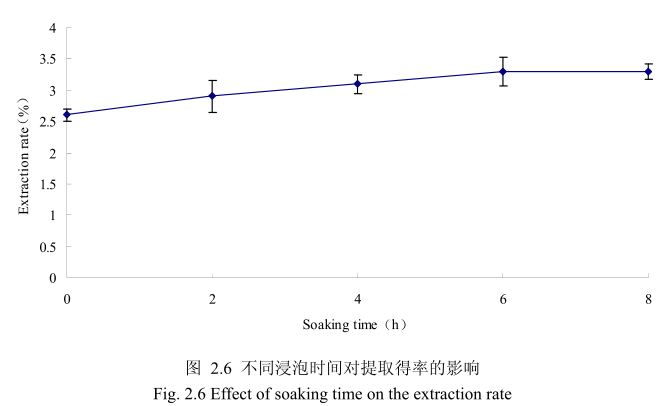
选择丁香花蕾粒径为40目、料液比1:8(质量比)、提取时间6小时。提取的浸泡时间分别为0小时、2小时、4 小时、6小时、8 小时进行提取实验,从图 2.6可以看出,浸泡时间在0到6小时时间范围内,丁香花蕾挥发油提取率随着浸泡时间的延长而增大。当浸泡时间为6小时时,挥发油的得率达到较大值,随着浸泡时间的进一步延长,挥发油的得率几乎没有变化。造成这种现象的原因可能是由于浸泡过程可以使植物的细胞间隙增大,细胞组织充分膨胀,从而加速细胞内外的液体交换与平衡。但是当浸泡达到一定时间后,细胞内外液体交换已经达到平衡,所以浸泡时间的进一步延长并不能改变挥发油的提取率。因此,选择浸泡时间为6小时时提取效率最高。
2.3.1.2.3 不同料液比对丁香花蕾挥发油得率的影响
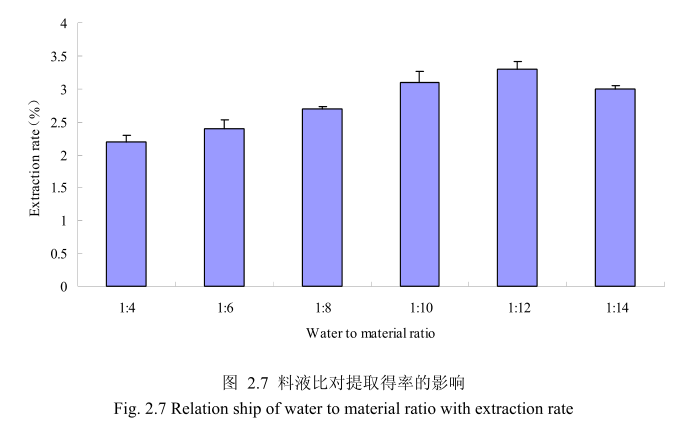
选择丁香花蕾粒径40目,浸泡时间6小时,提取时间6小时,料液比为1:4、1:6、1:8、1:10、1:12、1:14进行单因素实验。实验结果如图 2.7 所示,从图中可以发现,料液比从1:4变化到1:12的过程中丁香花蕾油的得率逐渐增加,料液比为1:12时丁香花蕾油的得率最大。得率增加的原因可能是由于水的增多使丁香花蕾中的丁香花蕾油与水接触面处的浓度差变大,有利于丁香花蕾油从组织中扩散出来。但当料液比从1:12变化到1:14的过程中,丁香花蕾油的得率反而逐渐减少。可能由于水的增加,造成挥发油在水中的损耗增加,但是水量增加到一定程度对了香花蕾油的扩散作用的影响已经不大,所以挥发油的得率降低。因此,当料液比为1:12时丁香花蕾油的得率最高。
2.3.1.2.4 不同提取时间对丁香花蕾挥发油得率的影响
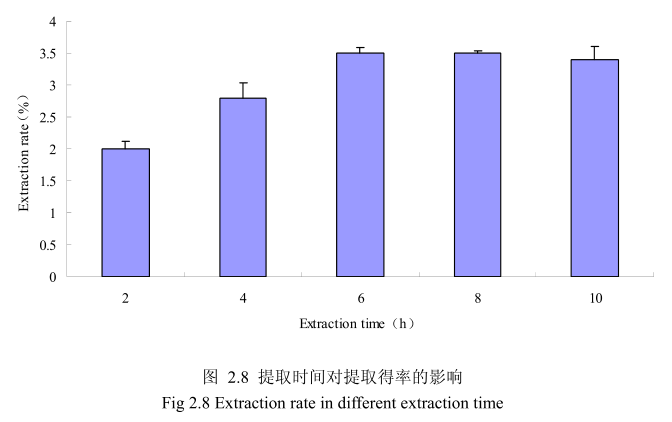
选择丁香花蕾粒径为40目、料液比1:12(质量比)、浸泡时间6小时、提取时间为2小时、4 小时、6小时、8小时、10 小时进行提取实验,从图2.8中可以看出随着提取时间的不断延长,丁香花蕾挥发油的得率显著提高,当提取时间达到6小时时,丁香花蕾挥发油的得率达到较大值,随着提取时间的进一步延长,丁香花蕾挥发油的得率并没有显著的变化。所以可以推测,当丁香花蕾提取到6时时体系的渗透压达到平衡,提取率趋于恒定,随着加热时间的延长,挥发油的提取效率并不能提高。
2.3.1.3 水蒸气蒸馏法提取香茅叶挥发油工艺优化
2.3.1.3.1 不同提取粒径对香茅叶挥发油得率的影响
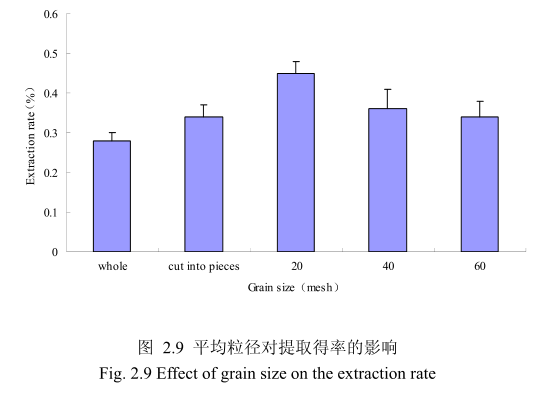
不同提取粒径对香茅叶挥发油的提取得率有一定的影响。选择提取浸泡时间6小时、料液比 1:10(质量比)、提取时间6小时、提取的粉碎粒径为整叶、剪碎、粉碎至20目、粉碎至40目、粉碎至60目进行提取实验,实验结果如图2.9所示。从图中可以看出,当香茅叶的提取粒径从整叶、剪碎到粉碎至 20目的过程中,香茅油的得率随着粉碎粒径的变细而增大,当粉碎粒径为20目时,挥发油的得率最高。该过程中由于香茅叶粉碎的越细,比表面积就越大,越有利于挥发油的浸出,所以挥发油的得率随着粉碎粒径的变小而增大。但是,当香茅叶的粉碎粒径变为40目和60目时,香茅挥发油的得率反而下降。这可能是由于粉碎粒径的变小让颗粒比表面积增大的同时,颗粒自身的表面吸附作用增加,从而抑制了挥发油的扩散。同时,挥发油具有较强的挥发性,当粉碎粒径过细时,粉碎过程中会有少量的挥发油挥发损失掉,从而降低了挥发油的最终得率。因此,从本实验可以看出,香茅叶提取平均粒径控制在20目时挥发油的得率最高。
2.3.1.3.2 不同浸泡时间对香茅叶挥发油得率的影响
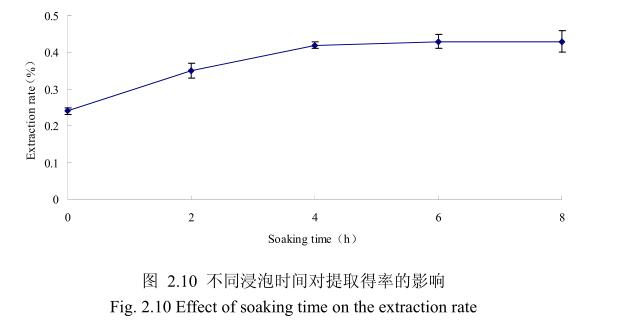
选择香茅叶粒径为20目、料液比1:10(质量比)、提取时间6小时、提取的浸泡时间分别为0小时、2小时、4 小时、6 小时、8 小时进行提取实验。从图2.10可以看出,在0到4时时间范围内,香茅叶挥发油提取率随着浸泡时间的延长而增大,在4小时时,挥发油的得率达到较大值,随着浸泡时间的进步延长,挥发油的得率几乎没有变化。造成这种现象的原因可能是由于浸泡过程可以使植物的细胞间隙增大,细胞组织充分膨胀,从而加速细胞内外的液体交换与平衡。但是当浸泡达到一定时间后,细胞内外液体交换已经达到平衡,所以浸泡时间的进一步延长并不能明显改变挥发油的提取率。因此,选择浸泡时间为4小时,此时提取效率最高。
2.3.1.3.3 不同料液比对香茅叶挥发油得率的影响
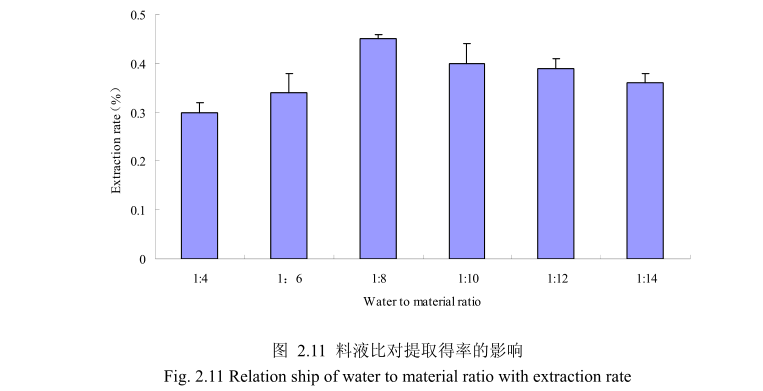
选择香茅叶粒径20目,浸泡时间4小时,提取时间6小时,料液比为1:4、1:6、1:8、1:10、1:12、1:14进行单因素实验。实验结果如图,从图中可以发现,料液比从1:4变化到1:8的过程中香茅叶油的得率逐渐增加,料液比为1:8时香茅叶油的得率最大。得率增加的原因可能是由于水的增多使香茅叶中的香茅油与水接触面处的浓度差变大,有利于香茅油的从叶片中扩散出来。但当料液比从1:8变化到1:14的过程中香茅油的得率反而逐渐减少。可能由于水的增加,造成挥发油在水中的损耗增加,但是水量增加到一定程度对香茅油的扩散作用的影响已经不大,所以挥发油的得率降低。因此,当料液比为1:8时香茅油的得率最高。
2.3.1.3.4 不同提取时间对香茅叶挥发油得率的影响
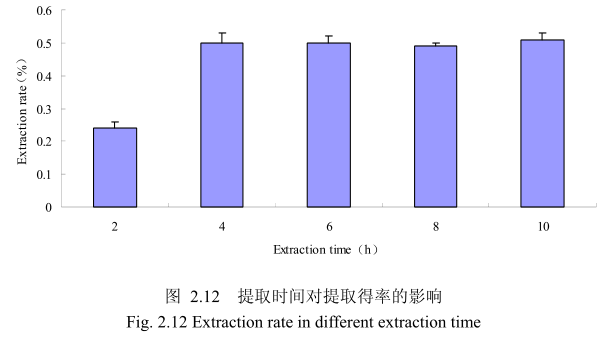
选择香茅叶粒径为20目、料液比1:8(质量比)、浸泡时间4小时、提取时间分别为 2小时、4 小时、6 小时、8 小时、10 小时进行提取实验,从图 2.12中可以看出随着提取时间的不断延长,香茅叶油的得率不断提高,当提取时间达到4小时时,香茅叶油的得率达到较大值,随着提取时间的进一步延长,香茅油的得率并没有显著的变化。所以可以推测,当香茅叶提取到4小时时,体系的渗透压达到平衡,提取率趋于恒定,随着加热时间的延长,挥发油的提取效率并不能提高。因此,当提取时间为4小时时,香茅油得率最高。
2.3.2 三种植物挥发油的物理指标
(1)丁香花蕾油:得率3.5%,澄清淡黄色液体,辛香及丁香酚的特征香气;相对密度 1.045(20/20℃);折光指数 1.5290(20℃)。
(2)山苍子油:得率2.7%,澄清淡黄色液体;感官特征:具有清鲜、甜的果香,类似柠檬油的香气;相对密度0.889(20/20℃);折光指数1.482(20℃)。
(3)香茅油:得率0.5%,澄清淡黄色液体;感官特征:具有轻快、新鲜的清甜果香,有成熟柠檬果皮的香气;相对密度0.889(20/20℃);折光指数 1.486(20℃)。
2.3.3 三种植物挥发油化学成分分析
2.3.3.1 山苍子油的化学成分
将最优提取条件下提取的山苍子油进行GC-MS分析。图2.13是山苍子油的GC-MS 图谱。从图2.13可以看出,山苍子油的化学成分较多,其中大多成分集中在保留时间5.0-25分钟之间。通过和标准品或质谱数据库数据比对,鉴定出19种化学成分,占总油含量的92.4%。表2.1为山苍子油成分和含量统计表。从表2.1可看出,广东产的山苍子果挥发油中相对含量较高的成分有E-柠醛(30.7%);Z-柠檬醛(26.7%);柠檬烯(8.1%);芳樟醇(5.2%);B-月桂烯(4.7%);a-松油醇(3.9%);B-蒎烯(2.7%);a-蒎烯(1.9%);香叶醇(1.3%);1.8-桉叶素(1.2%)等。
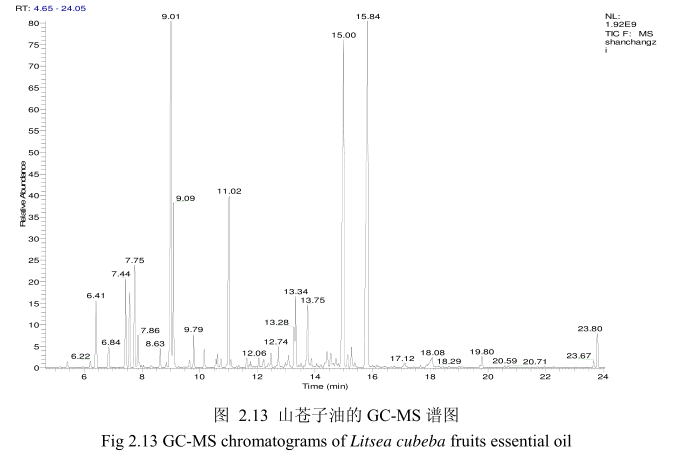

2.3.3.2 丁香花蕾油的化学成分
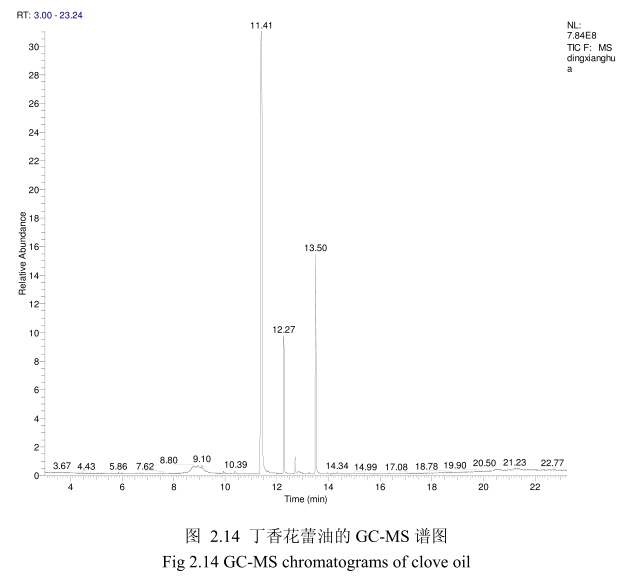
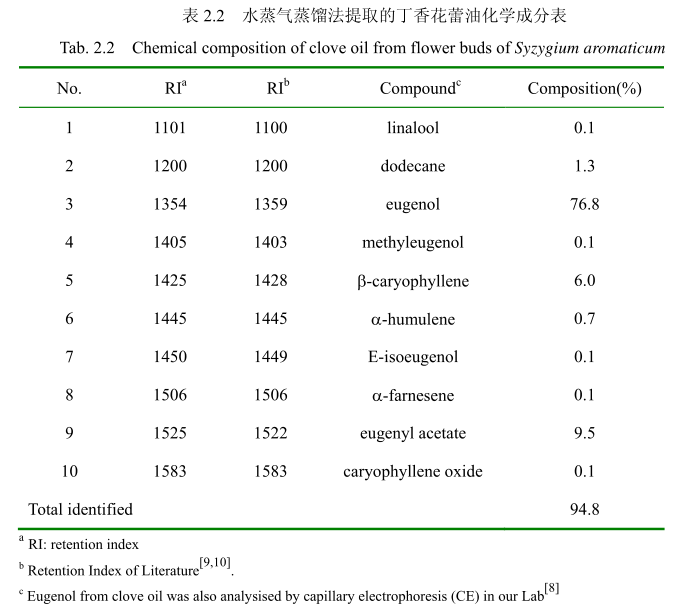
将最优提取条件下提取的丁香花蕾油通过GC-MS分析。图2.14是丁香花蕾油的GC-MS 图谱。从图2.14可以看出,丁香花蕾油的化学成分大多集中在保留时间 3.5-25分钟之间。通过和标准品或质谱数据库数据比对,鉴定出10种化学成分,占总油含量的94.8%。表2.2为鉴定出的丁香花蕾油成分和含量。从表2.2可看出,广东产的丁香花蕾油中相对含量较高的成分有丁香酚(76.8%)、乙酸丁香酯 (9.5%)、B-石竹烯(6.0%)、E-3-十二烯(1.9%)、2-1-十二烯(1.3%)等。
2.3.3.3.香茅油化学成分
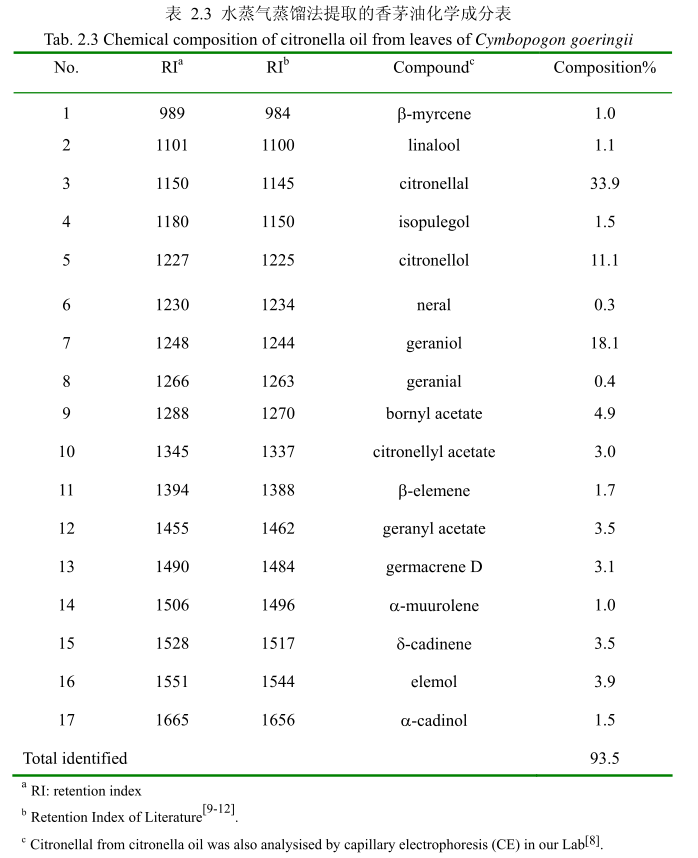
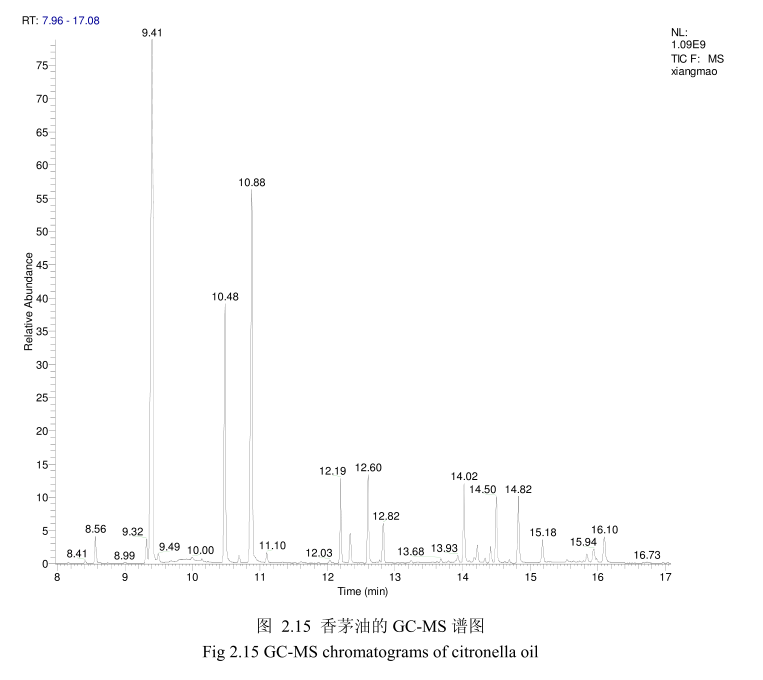
将最优提取条件下提取的香茅油通过GC-MS分析。图2.15是香茅油GC-MS图谱。从图2.15可以看出,香茅油的化学成分大多集中在保留时间6.0-17分钟之间。通过和标准品或质谱数据库数据比对,鉴定出17种化学成分,占总油含量的93.5%。表2.3为鉴定出的香茅油成分及含量。从表2.3可看出,其相对含量较高的成分为香茅醛(33.9%)、香叶醇(18.1%)和香茅醇(11.1%)等。
2.4 讨论
挥发油是一种成分非常复杂的天然混合物,通常含有20-60种成分,并且其含量差异很大。挥发油通常含有两种或三种主要特征成分,每种的含量可达20%-70%,而有些成分的含量非常少。通常情况下,挥发油的主要成分决定了挥发油的生物活性。挥发油的成分包含两类[13-16]。其中主要的一类由萜烯类和萜类化合物组成,另外一类由芳香族和脂肪族化合物组成,都属于小分子化合物。
萜类化合物是植物次生代谢产物,在自然界分布广泛,由异戊二烯单元组成的化合物及其衍生物,按照碳原子的数目可以分为单萜、倍半萜、二萜、三萜和多萜等。由于萜类化合物分子中具有不同的碳环数,因此又可分为链萜、单环萜、双环萜和三环萜等[17]。单萜由两个异戊二烯单元组成,是挥发油中最有代表性的分子,占挥发油组分的 90%,包含:桂叶烯、罗勒、萜品烯、水芹烯、香叶醇、芳樟醇香茅醇,、熏衣草醇、香橙醇、薄荷醇、松油醇、龙脑、小茴香醇、香叶醛、橙花醛香茅醛、薄荷酮、香芹酮、薄荷酮、胡椒酮、乙酸芳樟酯、乙酸异冰片酯、桉油素麝香草酚、香芹酚等。当分子具有旋光性,两种对映异构体常常存在于不同的植物中。
芳香化合物衍生于苯基丙烷,其种类少于萜类。萜类和芳香化合物在植物中合成路径是分开的,但在某些植物中是共用一条合成路径。芳香类化合物包括:桂皮醛、肉桂醇、丁香酚、茴香脑、肉豆蔻醚等
挥发油是一种混合物,其化学成分会因为植物物种、生长的地理环境、提取方法、采收时间等因素的差异而不同[18,19]。本章运用水蒸气蒸馏法提取的自然晾干的山苍子果实的挥发油呈淡黄色。GC-MS分析水蒸气蒸馏法提取的山苍子油鉴定出19种化学成分,占总油的92.4%。其主要成分柠檬醛的相对含量占57.4%,柠檬烯的含量占 8.1%,芳樟醇的含量为5.2%,B-月桂烯的相对含量为4.7%,a-松油醇的相对含量为3.9%,β-烯的相对含量为2.7%,α-蒎烯的相对含量为1.9%。本章运用 GC-MS 分析的山苍子油的主要化学成分与其它相关文献报道的山苍子油的主要化学成分基本一致[20,21],但是比例不同,从而证明天然挥发油含量的差异性[22]。例如,同一种类的山苍子油,其产地为美国,主要成分柠醛的相对含量为 85.7%,柠檬烯的相对含量为2.9%,芳樟醇的相对含量为1.7%。Wang等[23]研究的山苍子油中柠檬醛的含量为63.75%,柠檬烯的相对含量为7.38%,甲庚酮的相对含量为 3.54%,烯的相对含量为2.87%,4-伞花烃的含量为2.14%。
同样用GC-MS 分析产于中国广东的丁香花蕾油,鉴定出10种物质,占总油的 94.8%。主要成分丁香酚的相对含量为76.8%,乙酸丁香酯的相对含量为 9.5%,B-石竹烯的相对含量为6.0%。尽管其主要成分与其它文献报道的一致,但是其含量不一致。如产地为意大利的丁香花蕾油中丁香酚的相对含量为70.8%,B-石竹烯的相对含量为 24.9%,乙酸丁香酯的含量为4.2%。Moon 等[24]报道的丁香花蕾油中丁香酚的相对含量为76.8%,B-石竹烯的相对含量为17.4%,乙酸丁香酯的相对含量为 1.2%。
用GC-MS分析的香茅叶的挥发油鉴定出17种成分,占总油的93.5%。其中主要成分香茅醛的相对含量为33.9%、香叶醇的相对含量为18.1%、香茅醇的相对含量为11.1%。其主要成分与相关文献报道的香茅油的主要化学成分一致,但是其比例有一点差异。如中国云南产的香茅挥发油中主要成分香茅醛的含量为36.055%,香叶醇的含量为21.33%。
从本章分析的三种天然挥发油与其相关文献报道的结果相比较可以看出,尽管其主要化学成分一致,但是其含量有一定差异。而挥发油的化学成分及其含量决定了其生物活性,因此其挥发油的生物活性也可能存在较大差异。
2.5 本章小结
本章运用水蒸气蒸馏法萃取了产地中国广东的山苍子果实、丁香花蕾、香茅叶,获得挥发油的理化指标如下:
(1)山苍子油得率2.7%,澄清淡黄色液体;感官特征:具有清鲜、甜的果香,类似柠檬油的香气;相对密度0.889(20/20℃);折光指数1.482(20℃)。通过单因素实验,山苍子挥发油最佳提取工艺参数为山苍子粉碎至40目,浸泡时间8小时,料液比1:10,提取时间6小时。GC-MS分析山苍子油鉴定出19种化学成分,占总油的92.4%。其主要成分柠檬醛的相对含量占57.4%,柠烯的含量占8.1%,芳樟醇的含量为5.2%,B-月桂烯的相对含量为4.7%,a-松油醇的相对含量为3.9%,B-烯的相对含量为2.7%,a-的相对含量为1.9%。
(2)丁香花蕾油,得率3.5%,澄清淡黄色液体,辛香及丁香酚的特征香气;相对密度 1.045(20/20℃);折光指数15290(20℃)。通过单因素实验,丁香花蕾挥发油最佳提取工艺参数为丁香花蕾粉碎至40目,浸泡时间6小时,料液比1:12,提取时间6小时。用GC-MS 分析丁香花蕾油,鉴定出10种物质,占总油的94.8%。主要成分丁香酚的相对含量为76.8%,乙酸丁香酯的相对含量为9.5%,B-石竹烯的相对含量为6.0%。
(3)香茅油得率0.5%,澄清淡黄色液体;感官特征:具有轻快、新鲜的清甜果香,有成熟柠檬果皮的香气;相对密度0.889(20/20℃);折光指数 1.486(20℃)通过单因素实验,香茅叶挥发油最佳提取工艺参数为香茅粉碎至20目,浸泡时间4小时,料液比1:8,提取时间4小时。GC-MS 分析的香茅叶的挥发油鉴定出 17种成分,占总油的93.5%。其中主要成分香茅醛的相对含量为33.9%、香叶醇的相对含量为 18.1%、香茅醇的相对含量为11.1%。
2.6参考文献
[1] Masotti V, Juteau F, Bessie 're JM. Seasonal and phenological variations of the essential oil from the narrow endemic species Artemisia molinieri and its biological activities. Journal of Agricultural and Food Chemistry, 2003, 51:7115- -7121
[2] Jirovetz L, Buchbauer G, Stoilova I, et al. Chemical composition and antioxidant properties of clove leaf essential oil. Journal of Agricultural and Food Chemistry, 2006, 54(17):6303-6307
[3] Smith R, Cohen S, Doull J, et al. A procedure for the safety evaluation of natural flavor complexes used as ingredients in food: essential oils. Food and Chemical Toxicology, 2005, 43(3):345-363
[4]Huang B, Ban X, He J, et al. Comparative analysis of essential oil components and antioxidant activity of extracts of Nelumbo nucifera from various areas of China. Journal of Agricultural and Food Chemistry, 2009, 58(1):441-448
[5]Wang Q, Yang Y, Zhao X, et al. Chemical variation in the essential oil of Ephedra sinica from Northeastern China. Food Chemistry, 2006, 98( 1):52-58
[6] Wang HW, Liu YQ. Chemical composition and antibacterial activity of essential oils from different parts of Litsea cubeba. Chemistry & Biodiversity, 2010,7:229-235.
[7]Mockute D, Bernotiene G. The main citral-geraniol and carvacrol chemotypes of the essential oil of Thymus Pulegioides L. growing wild in Vilnius District (Lithuania). Journal of Agricultural and Food Chemistry,1999, 47: 3787-3790
[8]Huang XW, Yi L,Gao ZH, et al. Determination of seven active ingredients in three plant essential oils by using micellar electrokinetic chromatography. Analytical Letters, 2012,45, 2014-2015
[9]Jirovetz L, Buchbauer G, Stoilova I, et al. Chemical composition and antioxidant properties of clove leaf essential oil. Journal of Agricultural and Food Chemistry, 2006, 54, 6303-6307
[10] Kiran SR, Reddy AS, Devi PS,et al. Reddy, Insecticidal, antifeedant and oviposition deterrent effects of the essential oil and individual compounds from leaves of Chloroxylon swietenia DC. Pest Management Science, 2006, 62:1116-1121
[11] Lota ML, Serra DD, Tomi F,et al. Volatile components of peel and leaf oils of Lemon and Lime Species. Journal of Agricultural and Food Chemistry, 2002, 50:796-805
[12] Rajeswara R, Bhattacharya AK, Mallavarapu GR,et al. Yellowing and crinkling disease and its impact on the yield and composition of the essential oil of citronella (Cymbopogon winterianus Jowitt). Flavour Fragrance Jourmal, 2004, 19:344-350
[13]Da Silva EB, Matsuo AL, Figueiredo CR, et al. Chemical constituents and cytotoxic evaluation of essential oils from leaves of Porcelia macrocarpa(Annonaceae). Natural Product Communications, 2013, 8(2):277-279
[14]Betts TJ. Chemical characterisation of the different types of volatile oil constituents by various solute retention ratios with the use of conventional and novel commercial gas chromatographic stationary phases. Journal ofChromatography A, 2001, 936(1):33-46
[15]Setzer WN. Essential oils and anxiolytic aromatherapy. Natural Product Communications,2009,4(9): 1305-1316.
[16] Pichersky E, Noel JP, Dudareva N. Biosynthesis of plant voltiles: nature's diversity and ingenuity. Science Signaling, 2006, 311(5762):808-811
[17] 张长波,孙红霞,巩中军.植物萜类化合物的天然合成途径及其相关合酶.植物生理学通讯,2007,43(4) :779-785
[18] Lota ML, De Rocca Serra D, Tomi F, et al. Volatile components of peel and leaf oils of lemon and lime species. Journal of Agricultural and Food Chemitry, 2002, 50(4):796-805
[19] Lalko J, Api A. Investigation of the dermal sensitization potential of various essential oils in the local lymph node assay. Food and Chemical Toxicology, 2006, 44(5):739-746
[20] Gao Z, Xu H, Chen X, et al. Antioxidant status and mineral contents in tissues of rutin and baicalin fed rats. Life Sciences, 2003, 73(12):1599-1607
[21] Ho CL, Jie-Pinge O, Liu YC, et al. Compositions and in vitro anticancer activities of the leaf and fruit oils of Litsea cubeba from Taiwan. Natural Product
Communications, 2010, 5(4):617-620
[22] Liu ZL, Liu QR, Chu SS, et al. Insecticidal activity and chemical composition of the essential oils of Artemisia lavandulae folia and Artemisia sieversiana from China. Chemistry & Biodiversity, 2010, 7(8):2040-2045
[23] Wang H, Liu Y. Chemical composition and antibacterial activity of essential oils from different parts of Litsea cubeba. Chemistry & Biodiversity, 2010,
7(1):229-235
[24] Moon SE, Kim HY, Cha JD. Synergistic effect between clove oil and its major compounds and antibiotics against oral bacteria. Archives of Oral Biology, 2011 ,56(9):907-916
未完待续……

