生物材料与种子细胞的相互作用主要是材料表面物理及化学结构与细胞膜表面受体的相互识别,进而通过一系列信号转导通路影响细胞的粘附、分裂增殖、迁移分化以及发育生存等细胞行为。根据种子细胞和细胞表面受体,于材料表面引入特定生物活性因子或控制表面特定拓扑形貌结构,调控材料-细胞的相互作用,在不改变材料本体结构前提下,赋予材料表面可控的生物学性能,对细胞在材料上的功能发挥及维持有着极其重要的作用与意义,也是组织工程研究成功的关键点之一。
本文基于国内外最新研究结果,重点阐述生物材料表面修饰分子对细胞表型及功能的影响,为组织工程核心问题研究提供参考。
1 材料表面微形貌对细胞表型影响
材料对细胞行为的影响是多方面的,优化组织工程材料表面形貌可以提高材料的细胞相容性,改善组织整合和宿主反应[1]。材料表面微形貌包括多孔材料孔径、粗糙度、硬度、孔隙率、微纳结构等。孔隙率或孔径的增加通常会导致细胞外基质 (Extra cellular matrix,ECM) 分泌、细胞浸润、组织长入和分子传递的改善[2-4]。天然ECM 是典型的高孔隙结构,水和可溶性因子通过空隙填充和扩散,而且多孔结构为细胞附着和生长提供了较大的表面积,使分子能够高效转运,形成局部生物反应器进行生化反应[5]。因此,较高的孔隙率是生物高分子材料制备支架必备特征之一,它为组织生长所必需的细胞粘附、增殖提供一个平台,并起到物理引导作用。对于干细胞的分化,不同孔隙的物理参数可能导致不同的分化方向。例如,不需要添加生长因子等补充物,仅通过调整多孔蜂窝状聚苯乙烯支架孔径大小,直接诱导人间充质干细胞 (Mesenchymal stem cell,MSC) 的分化,平均孔径较小 (1.6 μm) 时支架诱导 MSC 特异性分化为成骨细胞,平均孔径较大 (4.8 μm) 时支架诱导 MSC 分化为成肌细胞[6]。
材料表面粗糙度是影响细胞粘附、增殖和成熟的重要因素之一。一般来说,粗糙的表面结构可以扩大材料与细胞的接触面积,促进细胞在多孔表面上的粘附、分化和增殖[7-8]。当增加水凝胶表面粗糙度,MSC 在水凝胶上形成稳定及更大面积的粘着斑,细胞与水凝胶的粘附力更强,使更多细胞粘附在材料上,并诱导 MSC 成骨分化[9]。粗糙的丝素蛋白/海藻酸钠材料表面可以粘附更多的红细胞,促进细胞生长,凝血速度更快,具有更强的凝血效果[10]。材料表面粗糙度不仅影响细胞行为,还会影响植入物的免疫反应[11]。表面亲水粗糙的生物材料可以产生抗炎微环境,用于提高对生物材料的愈合反应。表面光滑的钛倾向于诱导炎性巨噬细胞 (M1-like) 激活,增加白细胞介素 IL-1β、IL-6 和 TNFα 的水平。相反,亲水粗糙钛诱导巨噬细胞激活类似于抗炎 M2样状态,增加白细胞介素 IL-4 和 IL-10 的水平[12]。因此通过调节材料表面粗糙度和亲/疏水性可以调节植入体的炎症反应,控制干细胞分化。
纳米技术已成为一种非常强大的工具,可以模拟生物物理信号和改变细胞功能[13-14],通过仿生化设计,具有微/纳米结构层次结构的 3D 打印钛薄片,可以增强细胞的粘附和增殖,增加骨与植入物的接触,并且可直接与一些细胞膜受体发生相互作用[15]。与光滑表面相比,纳米纤维表面可以减弱巨噬细胞引起的免疫反应,粘附于纳米纤维材料表面的巨噬细胞倾向于维持原始的非极化状态,纳米纤维结构还可以促进巨噬细胞与ECM 相互作用,抑制炎症相关通路[16]。钛是常用的医用植入材料,纯钛力学性能较差,20 世纪 70 年代中期,力学性能更加优异,生物相容性与纯钛极为相似的 Ti-6Al-4V 合金成功用于临床。在Ti-6Al-4V 合金表面 3D 打印形成的二氧化钛纳米网状结构,可以增强细胞的活性,使成骨细胞粘着斑蛋白、肌动蛋白和碱性磷酸酶表达增加[17],促进成骨细胞粘附和增殖[18]。纳米纤维结构材料类似于天然 ECM 的纳米结构,能够以合适几何方向吸附介导细胞粘附的 ECM 分子,因此模拟ECM 的纳米纤维生物材料在生物医学中具有广阔的应用前景,在调节植入物免疫反应中具有重要的作用。
2 材料表面修饰分子对种子细胞表型的影响
细胞与生物材料结合时,细胞首先接触的是材料表面修饰分子,而不是材料本身,因此材料表面修饰分子是影响细胞附着在材料上的首要因素。组织工程中生物材料包括天然高分子材料、合成高分子材料和两者的复合材料,合成高分子材料机械性能较好,但细胞亲和性较差,材料不能为细胞的粘附、增殖和分化提供适当的支持,促进组织再生的能力相对较弱。为了提高生物性能,在支架表面接枝生物活性分子,如胶原蛋白、粘附肽、生长因子、激素和细胞因子[19-20],可以改善材料表面的亲疏水性、细胞亲和性等。然而,生物活性分子的细微变化也可改变其与细胞上特定整合素受体的相互作用,使细胞产生完全不一样的细胞行为,影响细胞活性和命运[21],因此必须根据生物活性分子种类、构象、硬度和密度等特点,精准控制活性分子与细胞表面整合素的相互作用,使细胞发挥我们所需的功能 (图 1)。
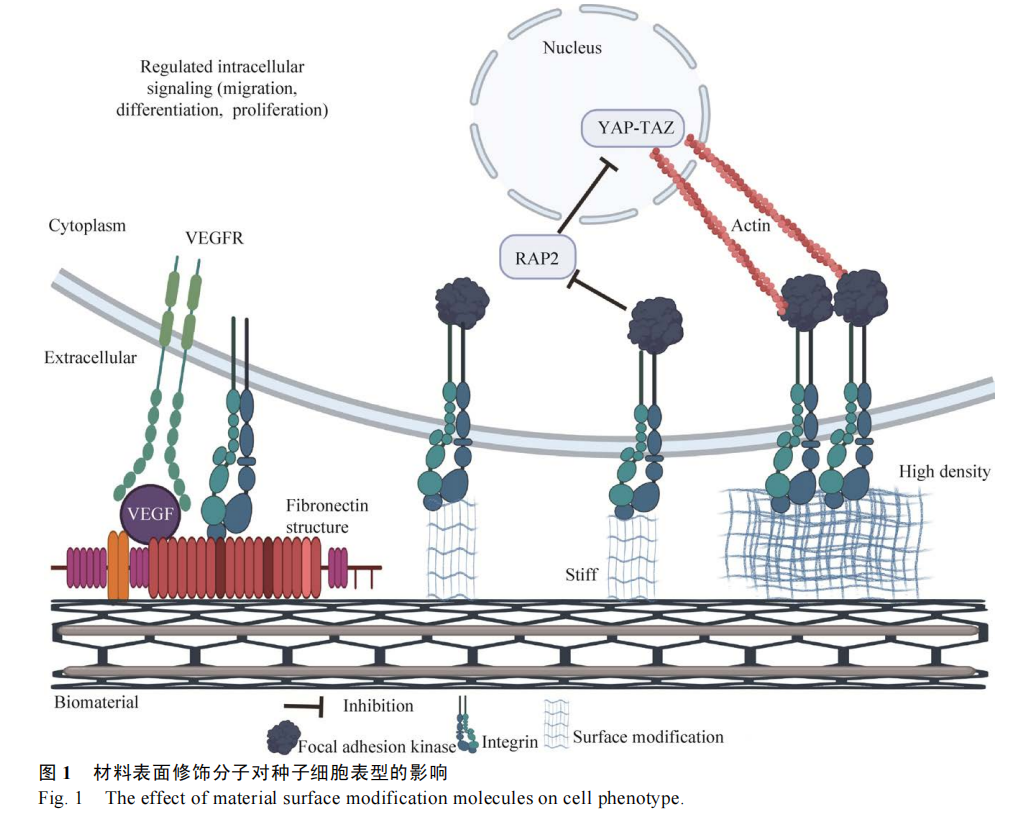
2.1 表面修饰分子通过细胞表面受体调控细胞表型
细胞粘附是细胞增殖等后续细胞行为的起点,细胞在材料上良好的附着是细胞发挥功能的前提。成骨细胞、肾小管上皮细胞、MSC 等种子细胞都是锚定依赖性生长,只有粘附在材料上,细胞才能生长、增殖并保持活力。细胞良好附着的关键是在材料上形成粘着斑复合体,该复合体由胞内和胞外两部分组成,胞内包含肌动蛋白、桩蛋白、踝蛋白、粘着斑激酶等多种蛋白以及整合素胞内段,胞外则由整合素胞外段、生长因子或胶原蛋白等 ECM 组成[22]。
整合素等细胞表面受体在生物材料与细胞相互作用中扮演关键角色,整合素不仅是粘着斑复合体的重要结构组成部分,还是细胞表面极其重要的受体之一,广泛表达于多种细胞表面,是细胞外微环境信号转导的重要桥梁[23]。细胞外微环境的 ECM、激素、生长因子、神经递质等配体,只有通过特异性结合细胞表面受体,才能发挥其生物学效应。ECM 等表面修饰分子可以结合一种或多种细胞表面受体,不仅通过粘着斑复合体使细胞粘附在材料表面,并且激活细胞内信号转导,改变细胞生长和增殖等生理过程。部分整合素受体如 α4β1 可以结合多种 ECM 配体,同一个 ECM配体也可以结合多种整合素并激活不同的信号通路[13]。因此,单一的表面改性分子对种子细胞粘附及增殖的作用有限,多种表面修饰分子同时使用能结合多种整合素,不仅可以形成稳定的粘着斑复合体,使细胞在材料上形成良好的粘附,还可以协同激活多个信号通路,控制细胞的成熟和分裂增殖。3D 打印肾小管里接枝明胶和纤维蛋白,明显促进近端肾小管上皮细胞 (Proximal tubular epithelial cell,PTEC) 的粘附,加速细胞融合和上皮成熟,成熟的单层上皮细胞是物质重吸收、分泌和运输的基础[24-26]。在聚砜-聚乙烯吡咯烷酮膜单独铺上Ⅳ型胶原蛋白 (Collagen Ⅳ,Col ) Ⅳ 或 3,4- 二羟基 -L- 苯基丙氨酸(3,4-dihydroxy-L-phenylalanine,L-DOPA) 尚不能充分改善人肾小管上皮细胞的性能,但同时铺上Col Ⅳ和 L-DOPA 后,肾小管上皮细胞活力明显改善,并且形成单层上皮细胞[27]。Zhang 等[28]在培养板上涂覆不同 ECM 后,探究永生化人肾小管上皮细胞 HK2 的生长状况。结果发现,单独铺上Matrigel、Ⅰ型胶原、明胶、Col Ⅳ或层黏连蛋白,HK2 细胞虽然能形成分化单层细胞,但是该融合单层细胞在 2 周后消失,当同时铺上 Col Ⅳ和层黏连蛋白,融合单层细胞可以持续到 3 周;同时他们发现原代人近端肾小管上皮细胞在复合多种细胞外基质 (Col Ⅳ[29]、巢蛋白、肾连蛋白和层黏连蛋白) 的涂层上生长状态更好,融合单层细胞持续 2 周,并且形成非常明显的持续 3 周的紧密连接。
2.2 Yap/Taz 是表面修饰分子硬度调控细胞表型的关键分子
人体内不同组织硬度差异较大,如柔软的脑组织硬度约几千帕[30],而坚硬的骨骼硬度可达几兆帕[31],在长期进化过程中,不同硬度组织里生长的细胞已经适应它们所处的机械环境,而且细胞对 ECM 硬度等机械特性非常敏感,因此如果细胞所处的生理状态下的细胞外机械环境发生细微变化,细胞的功能和命运就会发生明显改变[32]。已有大量研究表明基质硬度通过调控 Wnt 信号通路[33],诱导干细胞往不同方向分化,当硬度小于0.05 kPa 时,软基质上的干细胞能有效分化为神经细胞,而硬基质(>40 kPa)能有效促进成骨分化[34-35]。硬度较高的基质可有效促进细胞增殖,使细胞形成更大的粘着斑和肌动蛋白压力纤维[36],而柔软度高的基质无法抵抗细胞在粘附过程中产生的牵引力,细胞无法附着和扩散[37]。Yes 相关蛋白/PDZ结合域转录共激活子 (Yes-associated protein/ transcriptional coactivator with PDZ-binding motif, Yap/Taz) 是 Hippo 信号通路的下游效应分子,细胞外微环境的物理和机械信号通过 Yap/Taz 调节细胞形状,对细胞生存具有重要影响[38-39],在细胞分化和增殖方面有重要作用[40]。硬度较高的ECM 使 Yap/Taz 的表达增加,改变下游多个基因的表达水平 (如 MYC、FOSL1、CDK1) [41],影响干细胞的分化,软基质 (1–5 kPa) 促进 MSC 成脂分化[42],硬基质 (25–40 kPa) 则促进成骨分化[43-44]。当细胞从硬基质 (30 kPa) 移动到软基质 (1 kPa),Yap 和 Taz 从细胞核转移到细胞浆,而且软基质可诱导细胞表达 RAP2 (RAS 相关 GTPase),RAP2是细胞内信号转导分子开关,通过结合 MAP4K4、MAP4K6、MAP4K7和 ARHGAP29, 激活 LATS1 和LATS2,抑制 Yap 和 Taz 的活性[45]。因此,在组织工程中要考虑涂层硬度对细胞的影响,在材料表面涂上与体内生理环境 ECM 一致或相近硬度的基质,最大程度地模拟体内环境。另外由于体内 ECM 是动态变化的,在个体发育、器官形成和疾病中,ECM 发生沉积、重塑和降解,其组成、密度、硬度和构象的改变都会影响细胞的行为和功能[46]。工程化组织中生物材料在降解的同时,在各种特异性酶和细胞外微环境的作用下,材料表面修饰分子会发生降解[47],有可能影响种子细胞功能的发挥,因此深入了解表面修饰分子硬度、密度等机械特性对细胞功能的影响,有助于准确控制和维持种子细胞的功能,使工程化组织稳定地发挥功能。
2.3 表面修饰分子密度通过 YAP 分子调节细胞表型
表面修饰分子密度可以调节细胞粘附在材料后产生的牵引力[48],介导细胞形态及基因表达水平的改变,影响细胞运动及功能[49]。高密度细胞附着位点通过激活粘着斑激酶,诱导细胞膜上整合素-表面修饰分子聚集,增强整合素依赖的细胞内信号级联反应活性。平滑肌细胞特异性粘附在接枝缬氨酸-丙氨酸-脯氨酸-甘氨酸(Valine-alanine proline-glycine,VAPG)多肽的聚乙二醇表面,细胞更偏向于粘附到高密度 VAPG,并且从低密度VAPG 迁移到高密度 VAPG[50]。因此在生物材料设计时,可在材料表面引入与细胞表面受体特异性结合的配体并形成密度梯度,提高目标细胞粘附效率,控制细胞迁移方向,控制组织修复方向,提高组织修复效果。
González-García 等 [51] 研究纤维连接蛋白(Fibronectin,FN) 与聚丙烯酸乙酯 (Poly (ethyl acrylate),PEA) 之间相互作用强度对细胞粘附的影响时发现,当 FN 密度增加,细胞活力提高并促进细胞在 PEA 上的粘附。Marlar 等[52]在金表面添加不同密度的环精氨酸 -甘氨酸 -天冬氨酸(Cyclic arginine- glycine-aspartate, cRGD), 在cRGD 上培养 Madin-Darby 犬肾上皮细胞(Madin-Darby canine kidney epithelial Cells ,MDCK),研究发现,生长在高密度 cRGD 表面上的细胞呈上皮形态并成簇生长,而生长在稀疏cRGD 表面上的细胞则转变为伸长的、成纤维细胞样的形态。因此上皮细胞在稀疏 cRGD 表面容易发生上皮-间质转化 (Epithelial- mesenchymal transition,EMT),向间充质样细胞转分化,配体密度可以改变上皮细胞形态和表型。前面已经提到,Yap 是机械转导分子开关,是细胞与 ECM 相互作用的关键调控分子[53]。修饰分子硬度的增加导致转录因子 Yap 核转位,促进基因转录,但硬度诱导的 Yap 核转位只发生在中等水平密度的修饰分子上[11],在低密度 (0.1 mmol/L) 或高密度(2.5 mmol/L) FN 情况下,Yap 定位由修饰分子密度决定,与硬度无关,增加 FN 密度可直接诱导MSC 的成骨分化,而且密度诱导的 Yap 易位需要整合素 αVβ3聚集、粘着斑形成和细胞骨架张力协调完成;另外不同修饰分子调节 Yap 易位的密度差异较大,在软基质上 5 μg/mL Ⅰ型胶原已经可以诱导Yap 核转位,然而 Col Ⅳ需要 50 μg/mL 才能实现核转位,有趣的是与胶原蛋白和 FN 不同,层粘连蛋白在软基质上不能诱导 Yap 核转位,只有在硬基质上浓度为 20–50 μg/mL 情况下才能使 Yap核转位[8]。工程化组织在体内进行组织再生的同时,与体内其他细胞相互作用[54],最初的配体密度会发生改变,而且随着细胞持续分裂增殖后发生衰老[55]、凋亡[56]或者 EMT[57],种子细胞表型发生改变引起 ECM 重塑,ECM 的改变反过来影响细胞功能发挥及组织再生,因此 ECM 动态变化引起的细胞表型改变对组织再生效果影响不容小觑,在组织工程研究中,需要密切跟踪和检测生物材料表面修饰分子密度对细胞的影响。除此之外,不同组织和器官 ECM 的构成、比例、硬度和密度具有很大差异,在研究组织再生的生物化学线索时,必须综合考虑表面修饰分子对细胞分化和功能的影响,利用细胞-ECM 相互作用精确调控细胞命运,促进组织和器官再生。
2.4 表面修饰分子构象对细胞表型的影响
细胞与 ECM 或其他表面修饰分子的相互作用主要通过细胞表面整合素实现,整合素有 24 种亚型,但只有 8 种可以识别配体的 RGD 序列。而且在一些 ECM 分子中,如胶原蛋白和某些层粘连蛋白异构体,在变性或蛋白水解时才暴露与整合素结合的 RGD 序列,允许细胞通过受体结合在这些配体上[58]。在体内生理情况下,细胞通过整合素介导的收缩力使 FN 构象发生改变,形成纤维网络,暴露出 RGD 序列[59],激活细胞内信号转导级联反应[26]。但是在体外,FN 以不同的空间结构结合在材料表面,如 FN 以自然状态即球状吸附在聚 (丙烯酸甲酯) 材料表面,没有暴露整合素结合域[60],然而 FN 在 PEA 上自组装成与体内结构类似的纤维网络,该结构可明显提高成肌细胞活性,促进成肌细胞再生,而且吸附在 PEA表面的 FN 暴露出可与骨形态发生蛋白-2 (Bonemorphogenetic protein-2,BMP-2) 结合的结构域,促进 MSC 成骨分化,在较低生长因子浓度情况下,使体内骨缺损完全再生[61]。
BMP-2、成纤维细胞生长因子 2 (Fibroblast growth factor 2,FGF2)、成纤维细胞生长因子 9 (Fibroblast growth factor 9,FGF9) 等生长因子为干细胞增殖、迁移和分化提供有效成分,在再生医学中具有重要作用,因此在组织工程中往往需要添加生长因子来促进种子细胞的发育和组织再生。生长因子可以储存在 ECM 中,并形成浓度梯度的动态微环境以及局部的反应微环境[62]。血管内皮生长因子受体 -2 (Vascular endothelial growth factor receptor-2,VEGFR-2) 和整合素 αvβ3协同作用对血管形成具有重要作用[63],Moulisová等[64]发现 PEA 驱动 FN 暴露出血管内皮生长因子结合域 (FN Ⅲ 12-14) 和整合素结合域 (FN Ⅲ9-10),形成纳米网络,捕获并储存血管内皮生长因子 (Vascular endothelial growth factor,VEGF),协同整合素-VEGF 信号转导,使整合素 α5、αv 和VEGFR-2 共定位,促进细胞增殖、粘附和 DNA复制,在体外低浓度 VEGF 情况下有效促进血管形成。研究发现[65]在不含小分子化合物的情况下,FN 空间构象的微小变化对 MSC 粘附和生长具有重要影响。在不添加生长因子及其他小分子的情况下,组装在 PEA 上的纳米 FN 使 MSC 长时间维持干性 (30 d),细胞粘附面积增加,激活粘着斑激酶,进而激活细胞迁移、增殖和生长相关下游信号通路[66]。因此通过模拟体内生理情况下 ECM 的空间构象,表面修饰分子生理构象的形成明显改变细胞的命运和功能,不仅可以解决骨修复和血管化等组织修复和组织再生研究中高剂量生长因子产生的副作用和高成本问题,关键还可以通过控制与整合素结合的表面分子的构象,操纵决定细胞命运的细胞外微环境,获得所需的细胞活性和功能。由于整合素在种子细胞粘附和信号转导方面的重要性,细胞与生物材料表面改性分子的相互作用研究中,应该以整合素为核心,建立 ECM-整合素-信号转导通路-细胞功能关联图谱,从而精准地控制细胞行为和生存,并发挥细胞功能。
3 总结与展望
过去几年里,生物材料发展取得了巨大进展,有效控制和指导种子细胞的组织再生能力。材料制备技术的进步更好地模拟生理状态下的细胞微环境,可在分子水平和细胞水平调控细胞行为和功能表型,控制工程化组织再生效果[67]。通过先进材料合成技术[68],可以打印出具有关键细胞类型的大型细胞结构,以重现天然器官中的细胞与细胞/组织之间的相互作用,为生物材料表面修饰分子生物物理特性对细胞功能表型的研究开辟了新的途径并提供了强大的工具。
先进的材料制备技术可以更好地模拟 ECM和细胞外微环境,进行高度仿生化设计,而高通量的分析方法可以推进和加深我们对细胞与细胞/材料/细胞外微环境相互作用的理解,如以质谱成像技术为主的蛋白质组学研究,可以在空间上高精准地研究并理解材料与 ECM 等表面修饰蛋白分子以及细胞相互作用规律。不管是原位再生组织工程,控制细胞外微环境,传递重编程因子重新编程内源性细胞,刺激内源性细胞再生组织,还是传统植入性工程化组织,关键在于发挥目标/种子细胞的功能,组织工程的研究关键还是在于明确细胞-细胞、细胞-细胞外微环境以及材料之间的相互作用规律,以材料分子生物学为核心,以种子细胞功能发挥为目标,精细模拟体内特定细胞的微环境和微观结构,全景式绘制组织工程中关键功能细胞的分子调控网络,从而准确控制信号转导调控细胞行为及功能。
REFERENCES
[1] Hulshof F, Schophuizen C, Mihajlovic M, et al. New insights into the effects of biomaterial chemistry and topography on the morphology of kidney epithelial cells. J Tissue Eng Regen Med, 2018, 12(2): e817-e827.
[2] Loh QL, Choong C. Three-dimensional scaffolds for tissue engineering applications: role of porosity and pore size. Tissue Eng B: Rev, 2013, 19(6): 485-502.
[3] Zhou WC, Huang O, Gan YZ, et al. Effect of titanium implants with coatings of different pore sizes on adhesion and osteogenic differentiation of BMSCs. Artif Cells, Nanomed Biotechnol, 2019, 47(1): 290-299.
[4] Severn CE, Eissa AM, Langford CR, et al. Ex vivo culture of adult CD34+ stem cells using functional highly porous polymer scaffolds to establish biomimicry of the bone marrow niche. Biomaterials, 2019, 225: 119533.
[5] Huang GY, Li F, Zhao X, et al. Functional and biomimetic materials for engineering of the three-dimensional cell microenvironment. Chem Rev, 2017, 117(20): 12764-12850.
[6] Kawano T, Sato M, Yabu H, et al. Honeycomb-shaped surface topography induces differentiation of human mesenchymal stem cells (hMSCs): uniform porous polymer scaffolds prepared by the breath figure technique. Biomater Sci, 2014, 2(1): 52-56.
[7] Pan XM, Li YD, Abdullah AO, et al. Micro/nano-hierarchical structured TiO2 coating on titanium by micro-arc oxidation enhances osteoblast adhesion and differentiation. Royal Soc Open Sci, 2019, 6(4): 182031.
[8] Boyan BD, Cheng A, Olivares-Navarrete R, et al. Implant surface design regulates mesenchymal stem cell differentiation and maturation. Adv Dental Res, 2016, 28(1): 10-17.
[9] Hou Y, Yu LX, Xie WY, et al. Surface roughness and substrate stiffness synergize to drive cellular mechanoresponse. Nano Lett, 2019, 20(1): 748-757.
[10] Huang X, Fu Q, Deng YX, et al. Surface roughness of silk fibroin/alginate microspheres for rapid hemostasis in vitro and in vivo. Carbohyd Polym, 2021, 253: 117256.
[11] Andrukhov O, Behm C, Blufstein A, et al. Effect of implant surface material and roughness to the susceptibility of primary gingival fibroblasts to inflammatory stimuli. Dental Mater, 2020, 36(6): e194-e205.
[12] Hotchkiss KM, Reddy GB, Hyzy SL, et al. Titanium surface characteristics, including topography and wettability, alter macrophage activation. Acta Biomater, 2016, 31: 425-434.
[13] Amschler K, Schön MP. Modulating tumor cell functions by tunable nanopatterned ligand presentation. Nanomaterials, 2020, 10(2): 212.
[14] Necula MG, Mazare A, Ion RN, et al. Lateral spacing of TiO2 nanotubes modulates osteoblast behavior. Materials (Basel), 2019, 12(18): 2956.
[15] Yu MZ, Wan Y, Ren B, et al. 3D printed Ti-6Al-4V implant with a micro/nanostructured surface and its cellular responses. ACS Omega, 2020, 5(49): 31738-31743.
[16] Wu RX, Ma C, Liang YX, et al. ECM-mimicking nanofibrous matrix coaxes macrophages toward an anti-inflammatory phenotype: cellular behaviors and transcriptome analysis. Appl Mater Today, 2020, 18:
[17] Nune KC, Misra RDK, Gai X, et al. Surface nanotopography-induced favorable modulation of bioactivity and osteoconductive potential of anodized 3D printed Ti-6Al-4V alloy mesh structure. J Biomater Appl, 2017, 32(8): 1032-1048.
[18] Li Y, Song YJ, Ma AB, et al. Surface immobilization of TiO2 nanotubes with bone morphogenetic protein-2 synergistically enhances initial preosteoblast adhesion and osseointegration. BioMed Res Int, 2019, 2019: 5697250.
[19] Williams DF. Challenges with the development of biomaterials for sustainable tissue engineering. Front Bioeng Biotechnol, 2019, 7: 127.
[20] Przekora A. The summary of the most important cell-biomaterial interactions that need to be considered during in vitro biocompatibility testing of bone scaffolds for tissue engineering applications. Mater Sci Eng C, 2019, 97: 1036-1051.
[21] Humphrey JD, Dufresne ER, Schwartz MA. Mechanotransduction and extracellular matrix homeostasis. Nat Rev Mol Cell Biol, 2014, 15(12): 802-812.
[22] Li JP, Liu HJ, Takagi S, et al. Renal protective effects of empagliflozin via inhibition of EMT and aberrant glycolysis in proximal tubules. JCI Insight, 2020, 5(6): e129034.
[23] Bason C, Gallorini M, Berardi AC. The extracellular matrix, growth factors and morphogens in biomaterial design and tissue engineering//Berardi A, Ed. Extracellular Matrix for Tissue Engineering and Biomaterials. Cham: Humana Press, 2018: 3-26.
[24] Gomes AP, Ilter D, Low V, et al. Age-induced accumulation of methylmalonic acid promotes tumour progression. Nature, 2020, 585(7824): 283-287.
[25] Lin NYC, Homan KA, Robinson SS, et al. Renal reabsorption in 3D vascularized proximal tubule models. Proc Natl Acad Sci USA, 2019, 116(12): 5399-5404.
[26] Cheng ZA, Alba-Perez A, Gonzalez-Garcia C, et al. Nanoscale coatings for ultralow dose BMP-2-driven regeneration of critical-sized bone defects. Adv Sci, 2019, 6(2): 1800361.
[27] Ni M, Teo JCM, Bin Ibrahim MS, et al. Characterization of membrane materials and membrane coatings for bioreactor units of bioartificial kidneys. Biomaterials, 2011, 32(6): 1465-1476.
[28] Zhang HS, Tasnim F, Ying JY, et al. The impact of extracellular matrix coatings on the performance of human renal cells applied in bioartificial kidneys. Biomaterials, 2009, 30(15): 2899-2911.
[29] Homan KA, Kolesky DB, Skylar-Scott MA, et al. Bioprinting of 3D convoluted renal proximal tubules on perfusable chips. Scientific Reports, 2016, 6(1):
[30] Hiscox LV, Johnson CL, McGarry MDJ, et al. Mechanical property alterations across the cerebral cortex due to Alzheimer’s disease. Brain Commun, 2020, 2(1): fcz049.
[31] Hu QX, Liu MY, Chen GB, et al. Demineralized bone scaffolds with tunable matrix stiffness for efficient bone integration. ACS Appl Mater Interfaces, 2018, 10(33): 27669-27680.
[32] Murphy MC, Huston III J, Jack CR, et al. Decreased brain stiffness in Alzheimer’s disease determined by magnetic resonance elastography. J Magnet Resonan Imag, 2011, 34(3): 494-498.
[33] Liu NX, Zhou M, Zhang Q, et al. Stiffness regulates the proliferation and osteogenic/odontogenic differentiation of human dental pulp stem cells via the WNT signalling pathway. Cell Proliferat, 2018, 51(2): e12435.
[34] Olivares-Navarrete R, Lee EM, Smith K, et al. Substrate stiffness controls osteoblastic and chondrocytic differentiation of mesenchymal stem cells without exogenous stimuli. PLoS ONE, 2017, 12(1): e0170312.
[35] Zhang T, Lin SY, Shao XR, et al. Regulating osteogenesis and adipogenesis in adipose-derived stem cells by controlling underlying substrate stiffness. J Cell Physiol, 2018, 233(4): 3418-3428.
[36] Rens EG, Merks RMH. Cell shape and durotaxis explained from cell-extracellular matrix forces and focal adhesion dynamics. iScience, 2020, 23(9):
[37] Liu Y, Li L, Chen X, et al. Atomic force acoustic microscopy reveals the influence of substrate stiffness and topography on cell behavior. Beilst J Nanotechnol, 2019, 10(1): 2329-2337.
[38] Meng ZP, Moroishi T, Guan KL. Mechanisms of Hippo pathway regulation. Genes Dev, 2016, 30(1): 1-17.
[39] Halder G, Dupont S, Piccolo S. Transduction of mechanical and cytoskeletal cues by YAP and TAZ. Nat Rev Mol Cell Biol, 2012, 13(9): 591-600.
[40] Zhang SH, Zhou DW. Role of the transcriptional coactivators YAP/TAZ in liver cancer. Curr Opin Cell Biol, 2019, 61: 64-71.
[41] Totaro A, Panciera T, Piccolo S. YAP/TAZ upstream signals and downstream responses. Nat Cell Biol, 2018, 20(8): 888-899.
[42] Uhlen M, Fagerberg L, Hallström BM, et al. Tissue-based map of the human proteome. Science, 2015, 347(6220): 1260419.
[43] Chen L, Wu CH, Wei D, et al. Biomimetic mineralized microenvironment stiffness regulated BMSCs osteogenic differentiation through cytoskeleton mediated mechanical signaling transduction. Mater Sci Eng C, 2021, 119: 111613.
[44] Engler AJ, Sen S, Sweeney HL, et al. Matrix elasticity directs stem cell lineage specification. Cell, 2006, 126(4): 677-689.
[45] Meng ZP, Qiu YJ, Lin KC, et al. RAP2 mediates mechanoresponses of the Hippo pathway. Nature, 2018, 560(7720): 655-660.
[46] Walker C, Mojares E, Del Río Hernández A. Role of extracellular matrix in development and cancer progression. Int J Mol Sci, 2018, 19(10): 3028.
[47] Bonnans C, Chou J, Werb Z. Remodelling the extracellular matrix in development and disease. Nat Rev Mol Cell Biol, 2014, 15(12): 786-801.
[48] Oria R, Wiegand T, Escribano J, et al. Force loading explains spatial sensing of ligands by cells. Nature, 2017, 552(7684): 219-224.
[49] Chen JB, Zhou Y, Liu SY, et al. Biomechanical signal communication in vascular smooth muscle cells. J Cell Commun Signal, 2020, 14(4): 357-376.
[50] Shahmirzadi AA, Edgar D, Liao C-Y, et al. Alpha-ketoglutarate, an endogenous metabolite, extends lifespan and compresses morbidity in aging mice. Cell Metabo, 2020, 32(3): 447-456.e6.
[51] González-García C, Cantini M, Ballester-Beltrán J, et al. The strength of the protein-material interaction determines cell fate. Acta Biomater, 2018, 77: 74-84.
[52] Marlar S, Abdellatef SA, Nakanishi J. Reduced adhesive ligand density in engineered extracellular matrices induces an epithelial-mesenchymal-like transition. Acta Biomater, 2016, 39: 106-113.
[53] Chin RM, Fu XD, Pai MY, et al. The metabolite α-ketoglutarate extends lifespan by inhibiting ATP synthase and TOR. Nature, 2014, 510(7505): 397-401.
[54] Fernandes CJDC, Zambuzzi WF. Fibroblast-secreted trophic factors contribute with ECM remodeling stimulus and upmodulate osteocyte gene markers in osteoblasts. Biochimie, 2020, 168: 92-99.
[55] Woldhuis RR, De Vries M, Timens W, et al. Link between increased cellular senescence and extracellular matrix changes in COPD. Am J Physiol Lung Cell Mol Physiol, 2020, 319(1): L48-L60.
[56] Lü GH, Li L, Wang B, et al. LINC00623/miR-101/HRAS axis modulates IL-1β-mediated ECM degradation, apoptosis and senescence of osteoarthritis chondrocytes. Aging, 2020, 12(4): 3218-3237.
[57] Scott LE, Weinberg SH, Lemmon CA. Mechanochemical signaling of the extracellular matrix in epithelial-mesenchymal transition. Front Cell Dev Biol, 2019, 7: 135.
[58] Barczyk M, Carracedo S, Gullberg D. Integrins. Cell Tissue Res, 2009, 339(1): 269-280.
[59] Benito-Jardón M, Strohmeyer N, Ortega-Sanchís S, et al. αv-class integrin binding to fibronectin is solely mediated by RGD and unaffected by an RGE mutation. J Cell Biol, 2020, 219(12): e202004198.
[60] Salmerón-Sánchez M, Rico P, Moratal D, et al. Role of material-driven fibronectin fibrillogenesis in cell differentiation. Biomaterials, 2011, 32(8): 2099-2105.
[61] Llopis-Hernández V, Cantini M, González-García C, et al. Material-driven fibronectin assembly for high-efficiency presentation of growth factors. Sci Adv, 2016, 2(8): e1600188.
[62] Briquez PS, Clegg LE, Martino MM, et al. Design principles for therapeutic angiogenic materials. Nat Rev Mater, 2016, 1(1): 15006.
[63] Traub S, Morgner J, Martino MM, et al. The promotion of endothelial cell attachment and spreading using FNIII10 fused to VEGF-A165. Biomaterials, 2013, 34(24): 5958-5968.
[64] Moulisová V, Gonzalez-García C, Cantini M, et al. Engineered microenvironments for synergistic VEGF——Integrin signalling during vascularization. Biomaterials, 2017, 126: 61-74.
[65] Rico P, Mnatsakanyan H, Dalby MJ, et al. Material-driven fibronectin assembly promotes maintenance of mesenchymal stem cell phenotypes.
Adv Funct Mater, 2016, 26(36): 6563-6573.
[66] Mitra SK, Hanson DA, Schlaepfer DD. Focal adhesion kinase: in command and control of cell motility. Nat Rev Mol Cell Biol, 2005, 6(1): 56-68.
[67] Hong J, Yeo M, Yang GH, et al. Cell-electrospinning and its application for tissue engineering. International J Mol Sci, 2019, 20(24): 6208.
[68] Brassard JA, Nikolaev M, Hübscher T, et al. Recapitulating macro-scale tissue self-organization through organoid bioprinting. Nat Mater, 2020,20(1): 22-29.
本文献转载于生物工程学报,不代表本网站赞同其观点和对其真实性负责,我们主要用于阅读分享,非商业用途,如若侵权,请告知删除。


