0 引言 Introduction
糖尿病是一种由于胰岛素分泌缺陷或胰岛素作用障碍所致的以高血糖为特征的代谢性疾病 [1]。据国际糖尿病联合会报道:全世界大约有 3 亿人患有糖尿病,并呈上升趋势。1型糖尿病多由胰岛 β 细胞自身免疫破坏所致,而较为常见的2 型糖尿病主因胰岛素抵抗和胰岛 β 细胞功能障碍所致 [1-2]。对于糖尿病患者,尤其是 1 型糖尿病患者,必须使用外源性胰岛素来控制血糖稳定。尽管胰岛素治疗效果不错,但其不能消除糖尿病所带来的慢性并发症,例如心血管疾病、肾功能衰竭、视网膜病变和神经病变等 [3-4]。STEPHENS 等 [5] 将正常鼠胰岛用 1 型寡聚胶原包裹移植到糖尿病鼠皮下,发现其可以降低血糖并维持血糖稳定 90 d。但由于胰岛供者的缺少也限制了此种方法在临床上的应用。
近些年来,科学家们发现移植间充质干细胞可以治疗糖尿病。间充质干细胞是一类具有多向分化潜能的多能干细胞,可诱导分化成骨细胞 [6-7]、脂肪细胞 [7]、心肌细胞 [8]、胰岛 β细胞 [9]。WANG 等 [10] 将人脐带间充质干细胞移植到 1 型糖尿病大鼠体内,可降低其血糖并修复胰岛功能;YU 等 [11] 将脂肪间充质干细胞移植到 2 型糖尿病大鼠体内,不仅可以降低血糖而且可改善相应并发症。目前认为间充质干细胞治疗糖尿病主要机制为:①在胰腺微环境下定向诱导分化为胰岛β 细胞,代替受损胰岛功能 [12];②通过释放抗炎和免疫调节因子,修复胰岛功能 [13];③通过归巢和旁分泌多种细胞因子以及核酸片段,改善胰岛细胞微环境 [13]。为了更好地发挥间充质干细胞治疗糖尿病的效果,科学家们对其进行体外诱导,在相关因子的作用下使其分化为能分泌胰岛素的细胞,即胰岛样细胞,将其移植到糖尿病鼠体内,发现其降糖效果优于直接移植间充质干细胞 [14]。
目前胰岛样细胞移植治疗糖尿病的主要途径有尾静脉移植[15]、门静脉移植[14,16]、肾被膜移植[17],而腹腔移植少有报道。李兰兰等 [18] 实验研究发现人脐带间充质干细胞诱导分化的胰岛素分泌细胞在体外保持低免疫原性,但移植到体内后由于微环境的变化而具有一定免疫原性。虽然移植后会存在一定免疫原性,但腹腔含有丰富的血管网,便于胰岛样细胞获得血供和养分,也便于其感受外周循环中糖浓度的变化同时迅速向血液中释放胰岛素,从理论上来判断腹腔应该是胰岛样细胞移植较为理想的位点。EL-TANTAWY 等 [19] 通过腹腔移植骨髓间充质干细胞于 1 型糖尿病大鼠体内,可对其高血糖、高脂血症和氧化应激等多方面进行改善。故而,该实验将人脐带间充质干细胞诱导分化为胰岛样细胞,对比观察尾静脉移植和腹腔移植治疗 1 型糖尿病鼠的效果,为移植胰岛样细胞治疗糖尿病寻求更佳的移植方式。
1 材料和方法 Materials and methods
1.1 设计 对比观察动物实验。
1.2 时间及地点 2017 年 10 月至 2019 年 10 月在山西医科大学生物化学与分子生物学教研室完成。
1.3 材料
1.3.1 脐带组织 来源于山西医科大学附属第一医院产科健康婴儿脐带组织,经产妇及家属知情同意并已签署知情同意书。
1.3.2 实验动物 健康雄性 C57BL/6J 小鼠 15 只,6-8 周龄,体质量 20-22 g,由山西医科医科大学实验动物中心提供,许证号:SCXK( 晋 )2015-0001。
1.3.3 实验试剂与仪器 倒置显微镜 (Nikon,日本 );超净工作台 ( 上海博讯医疗设备厂,中国 );恒温细胞培养箱 ( 上海力申科学仪器有限公司,中国 );人脐带间充质干细胞成骨、成脂诱导分化培养基试剂盒 (Cyagen,美国 );小鼠抗人CD90-FITC、CD34-PE、CD29-PE、CD44-PE、CD45-APC(BD,美国);尼克酰胺、链脲佐菌素、双硫腙(Sigma,美国);表皮生长因子、碱性成纤维细胞生长因子 (PeproTech,美国 );活化素 A( 上海爱必信生物科技有限公司,中国 );胰岛素 / 转铁蛋白 /硒 (Gibco,美国 );人 C 肽定量 ELISA 试剂盒 ( 上海西唐生物科技有限公司,中国 );人超敏胰岛素 ELISA 试剂盒 (ALPCO,美国 );RevertAidlst cDNA Synth Kit(Thermo Scientific,美国 );SYBR premix EX Taq(Takara,日本 )。
1.4 实验方法
1.4.1 人脐带间充质干细胞的分离与培养 采用组织块贴壁分离培养方法 [20-21],待细胞爬出且融合度达到 50%-60% 时,弃去组织块。细胞生长至 80%-90% 融合度时用胰蛋白酶消化传代,比例为 1 ∶ 2 或 1 ∶ 3。
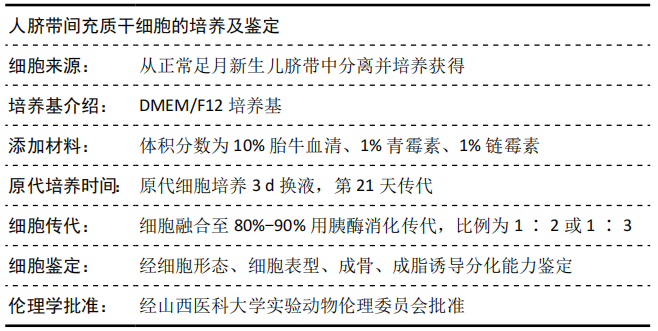
1.4.2 人脐带间充质干细胞的表型鉴定 流式细胞仪检测细胞表面标志物 CD29、CD34、CD90、CD45、CD44 的表达。
1.4.3 人脐带间充质干细胞的成骨、成脂诱导分化 严格按照人脐带间充质干细胞成骨、成脂诱导分化培养基试剂盒说明书进行操作。
1.4.4 人脐带间充质干细胞向胰岛样细胞分化 取生长状态良好的第 4 代人脐带间充质干细胞,待细胞融合度达到80%-90% 时诱导其向胰岛样细胞分化,共分为 4 个阶段 [14-17]。第 1 阶段:加入诱导液 1 培养 3 d;第 2 阶段:加入诱导液2 培养 5 d,间隔两三天更换新鲜培养液;第 3 阶段:加入诱导液 3 培养 5 d,间隔两三天更换新鲜培养液;第 4 阶段:加入诱导液 4 培养 14 d,间隔两三天更换新鲜培养液。诱导液 1:DMEM/F12+4 nmol/L 活化素 A;诱导液 2:DMEM/F12+10 mmol/L 尼克酰胺 +25 µg/L 表皮生长因子;诱导液 3:DMEM/F12;诱导液 4:DMEM/F12+10 mmol/L 尼克酰胺 +10 µg/L 碱性成纤维细胞生长因子 + 胰岛素 / 转铁蛋白 / 硒。
1.4.5 双硫腙染色 取双硫腙粉末 10 mg 溶于 1 mL 二甲基亚砜中,配成储备液 -20 ℃保存备用,使用之前 0.22 µm 孔径滤膜过滤,取 10 µL 加入 1 mL 胰岛样细胞培养基中,37 ℃孵箱中孵育 30 min,PBS 洗 3 次,显微镜下观察。
1.4.6 C 肽水平检测 诱导完成后,弃去培养液,PBS 洗 2次,加入 L-DMEM(5.5 mmol/L 葡萄糖 ) 孵育 2 h,收集培养液;诱导完成后,弃去培养液,PBS 洗 2 次,加入 H-DMEM(25 mmol/L 葡萄糖 ) 孵育 2 h,收集培养液。严格按照人 C 肽定量 ELISA 试剂盒说明书,分别检测低糖 (5.5 mmol/L) 和高糖 (25 mmol/L ) 刺激胰岛样细胞 2 h 后 C 肽水平。
1.4.7 实时荧光定量 PCR 检测 Insulin、PDX1 mRNA 相对表达量 收集诱导完成后的胰岛样细胞,采用 Trizol 法提取细胞总 RNA,用 RevertAidlst cDNA Synth Kit 反转录试剂盒进行反转录反应,用 SYBR Premix EX Taq 检测试剂盒进行实时荧光定量 PCR 检测,以 GAPDH 作为样品内参。GAPDH 正向引物:5’-AGA AGG CTG GGG CTC ATT TG-3’,反向引物:5’-AGG GCC ATC CAC AGT CTT C-3’;Insulin 正向引物:5’-ATC AAG CAG ATC ACT GTC CTT CT-3’,反向引物:5’-GAG AGC TTC CAC CAG GTG TG-3’;PDX1 正向引物:5’-TCC CAT GGA TGA AGT CTA CC-3’, 反向引物:5’-TGT CCT CCT CCT TTT TCC AC-3’,采用 ΔΔCT 法进行数据分析。
1.4.8 动物分组及1型糖尿病鼠模型建立 15只雄性C57BL/6J 小鼠经适应性喂养 1 周后,随机取 3 只作为正常组,其余小鼠给予 55 mg/kg 链脲佐菌素连续 5 d 腹腔注射 [5] ( 过夜禁食 12 h 后给药,给药后 2 h 进食 )。在给药后 7,10 d 取尾静脉血检测血糖 ( 早 10:00 禁食,下午 16:00 测血糖,实验期间禁食不禁水 ),2 次都超过 16.7 mmol/L,即为 1 型糖尿病鼠。符合糖尿病标准 9 只小鼠随机分为 3 组:糖尿病组、尾静脉 -胰岛样细胞组、腹腔 - 胰岛样细胞组,每组 3 只。
1.4.9 胰岛样细胞移植 诱导完成后,将胰岛样细胞用胰蛋白酶消化,生理盐水清洗 3 次,生理盐水重悬细胞沉淀使其细胞浓度为 1.25×109 L-1。造模 10 d 后,正常组、糖尿病组不予处理,尾静脉 - 胰岛样细胞组经尾静脉注射 0.4 mL 胰岛样细胞悬液 ( 含 5×105 个细胞 ),腹腔 - 胰岛样细胞组经腹腔注射0.4 mL胰岛样细胞悬液(含5×105 个细胞)。早 10:00禁食,下午 16:00 测血糖,每周三、周日检测 2 次血糖,共 6 周。
1.4.10 葡糖糖耐量实验 移植后 28 d,对各组小鼠进行葡萄糖耐量实验。禁食 6 h 后,每组小鼠腹腔注射葡萄糖 (2.0 g/kg),取尾静脉血,检测 0,60,120 min 血糖浓度。
1.4.11 胰岛素水平检测 移植后 42 d,各组小鼠禁食 6 h 后,4% 水合氯醛麻醉,眼球取血,离心后取上清,严格按照人超敏胰岛素 ELISA 试剂盒说明书检测胰岛素水平。
1.5 主要观察指标 ①人脐带间充质干细胞的形态;②人脐带间充质干细胞表型鉴定;③人脐带间充质干细胞成脂、成骨诱导分化能力;④人脐带间充质干细胞向胰岛样细胞诱导过程中形态变化;⑤胰岛样细胞双硫腙染色结果;⑥低糖、高糖刺激下胰岛样细胞 C 肽水平;⑦胰岛样细胞 Insulin、PDX1 mRNA 表达;⑧各组小鼠血糖、血清胰岛素水平和葡萄糖耐量实验结果。
1.6 统计学分析 实验数据用 SPSS 20.0 统计软件进行分析。采用 t 检验进行组间比较,单因素方差分析进行多组间比较,P < 0.05 为差异有显著性意义。
2 结果 Results
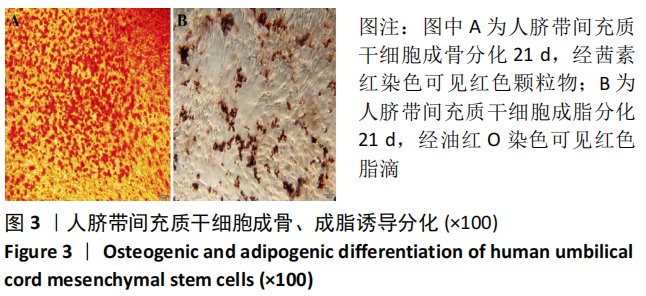
2.1 人脐带间充质干细胞的形态 原代培养第 7 天可见脐带组织块周围有贴壁细胞爬出,细胞大小不一,呈多角形或梭形。待生长至 80%-90% 融合度时,进行消化传代。传至第 3 代时,细胞呈形态大小均一的长梭形漩涡状,见图 1。
2.2 人脐带间充质干细胞的表型鉴定结果 流式细胞仪检测第 3 代人脐带间充质干细胞表面抗原,结果显示 CD90、CD44、CD29 的阳性率分别为 99.2%,99.8%,100.0%,CD45、CD34 的阳性率分别为 0.1%,0.0%,见图 2。
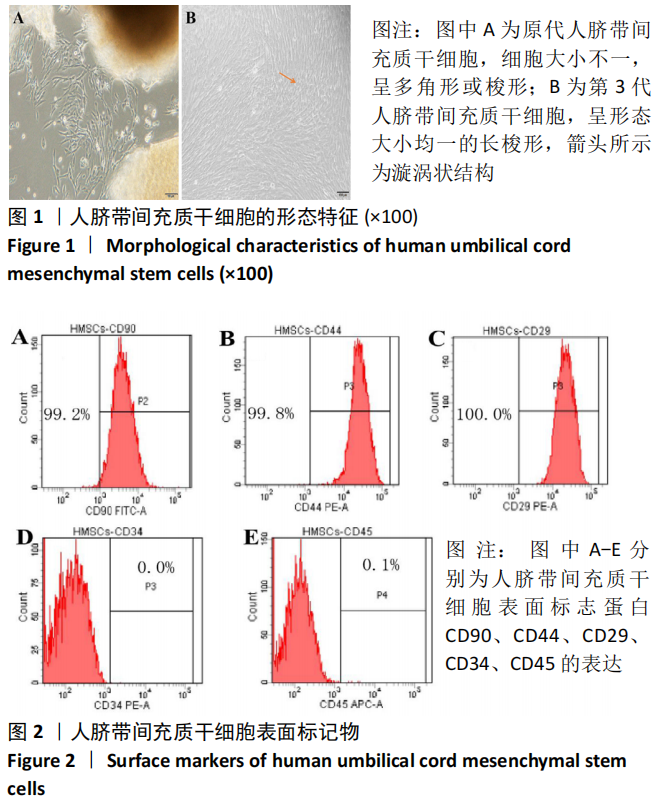
2.3 人脐带间充质干细胞成骨、成脂诱导分化能力 人脐带间充质干细胞成骨诱导 21 d 后,经茜素红染色可见红色颗粒物。成脂诱导 21 d 后,油红 O 染色呈可见大量油样的红色空泡。结果表明人脐带间充质干细胞可向成骨细胞、成脂细胞方向分化,见图 3。
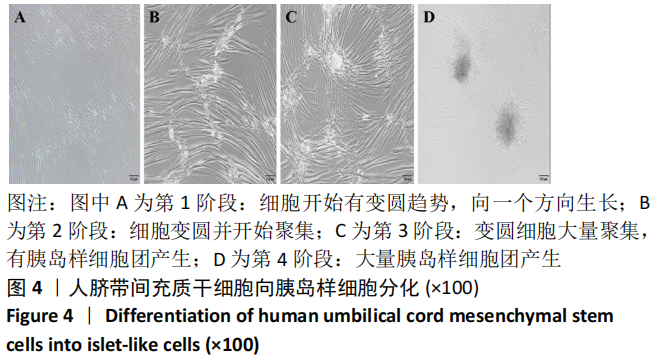
2.4 人脐带间充质干细胞向胰岛样细胞分化过程中形态变化人脐带间充质干细胞向胰岛样细胞分化共分为 4 个阶段。第1 阶段:细胞开始有变圆趋势,向一个方向生长;第 2 阶段:细胞变圆并开始聚集;第 3 阶段:变圆细胞大量聚集,有胰岛样细胞团产生;第 4 阶段:大量胰岛样细胞团产生,见图 4。
2.5 双硫腙染色结果 双硫腙可特异性结合胰岛素分子中的锌离子,胰岛样细胞经双硫腙染色形成红棕色胰岛样细胞团,见图 5。

2.6 C 肽水平 诱导完成后,分别以低糖 (5.5 mmol/L) 和高糖(25 mmol/L ) 刺 激 胰 岛 样 细 胞,C 肽水平分别为 0.528,0.785 µg/L,差异有显著性意义 (P < 0.05),见图 6。
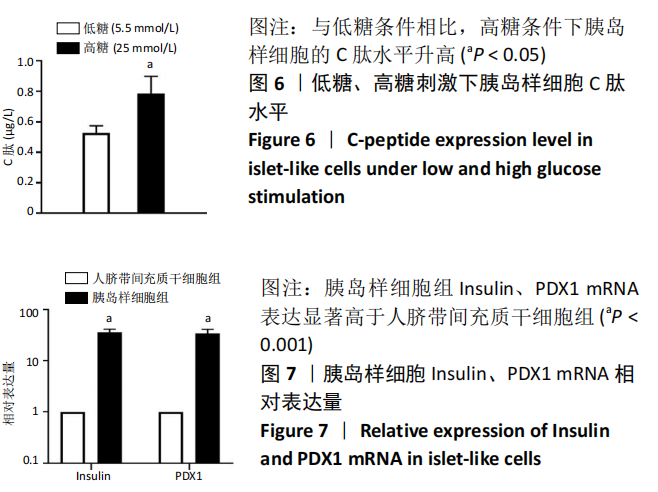
2.7 胰岛样细胞 RT-PCR 检测结果 胰岛样细胞的 Insulin、PDX1 mRNA 表达显著高于未诱导的人脐带间充质干细胞,差异有显著性意义 (P < 0.001),见图 7。
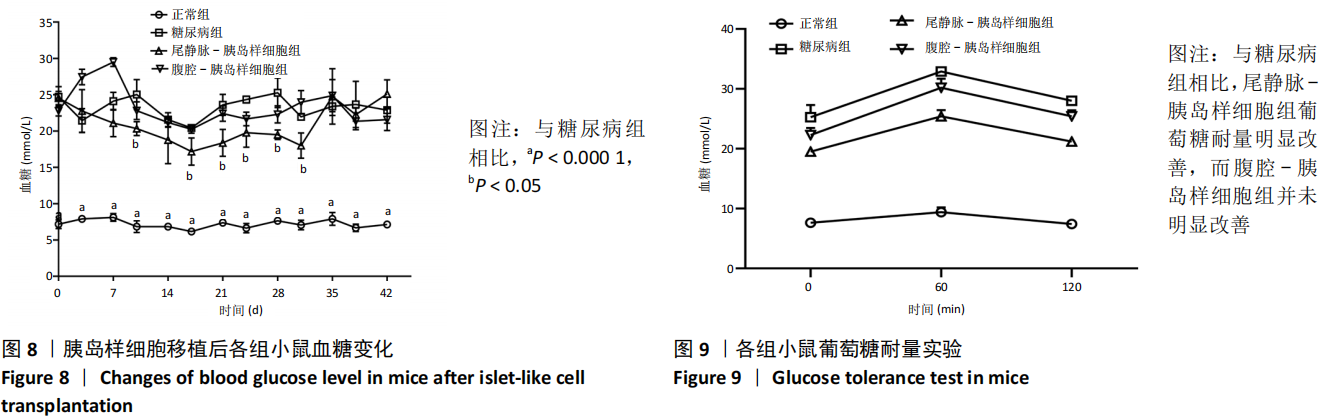
2.8 各组小鼠血糖水平 在移植观察 42 d 周期内,正常组血糖水平远低于糖尿病组,差异有显著性意义 (P < 0.000 1)。尾静脉 - 胰岛样细胞组血糖下降,第 10 天开始与糖尿病组差异有显著性意义 (P < 0.05),一直维持到 31 d。腹腔 - 胰岛样细胞组在移植后血糖开始上升,1 周后下降,此后略低于糖尿病组,差异无显著性意义 (P > 0.05),见图 8。
2.9 各组小鼠葡萄糖耐量实验结果 移植后 28 d,对各组进行腹腔注射葡萄糖耐量实验。与糖尿病组相比,正常组 2 h后血糖水平恢复正常;尾静脉 - 胰岛样细胞组葡萄糖耐量明显改善,血糖水平接近起始血糖水平,而腹腔 - 胰岛样细胞组血糖水平并未恢复至起始血糖水平,见图 9。
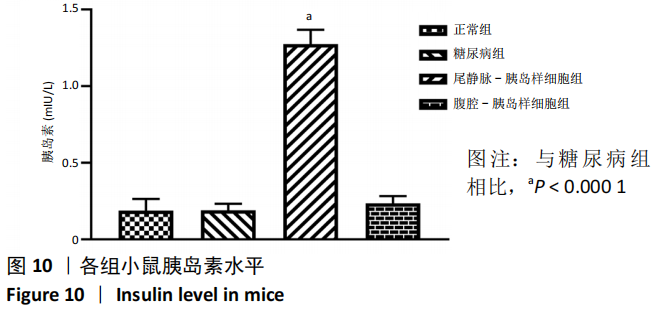
2.10 各组小鼠胰岛素水平 见图 10。
移植后42 d,正常组、糖尿病组、尾静脉-胰岛样细胞组、腹腔 - 胰岛样细胞组胰岛素水平分别为 0.188,0.191,1.273,0.236 mIU/L。与糖尿病组相比,尾静脉 - 胰岛样细胞组胰岛素水平升高,差异有显著性意义 (P < 0.000 1),而腹腔 - 胰岛样细胞组胰岛素水平未见升高,差异无显著性意义 (P > 0.05)。
3 讨论 Discussion
糖尿病已成为继心脑血管疾病、肿瘤之后另一个严重危害人们健康的重要慢性非传染性疾病,而中国糖尿病流行形势尤为严峻,近些年来患病率不断攀升,患病人数高居世界第一 [22]。胰岛素是目前治疗 1 型糖尿病最好的药物,但它并不可以完全治愈糖尿病。
近些年来,科学家们发现可以通过移植间充质干细胞治疗糖尿病 [10-13],替代胰岛素疗法,但这种治疗方法也是有限的,它并不能一直维持糖尿病鼠血糖的稳定,只能起到短期维持作用。为了更好地发挥治疗效果,科学家们在体外诱导间充质干细胞向胰岛样细胞分化,从而移植到糖尿病鼠体内 [14-17]。目前,胰岛样细胞治疗糖尿病主要移植方式有尾静脉移植、门静脉移植、肾被膜移植。尾静脉移植方式在体液循环下经过门静脉阻滞,导致治疗效果并不显著。门静脉和肾被膜移植方式虽取得不错的治疗效果,但创伤性较大。而腹腔移植方式简便,创伤性小,并含有丰富的血管网,便于细胞摄取营养物质,胰岛素释放入血,理论上来看应该是一个理想的移植位点。
人脐带间充质干细胞由于其来源广泛、易于获取、低免疫原性、不涉及伦理问题等优点 [23-26],故该实验将人脐带间充质干细胞作为种子细胞,在相关因子诱导下使其成为胰岛样细胞。通过尾静脉和腹腔移植 2 种方式移植到 1 型糖尿病鼠体内,寻求最佳移植方式。实验结果表明,尾静脉 - 胰岛样细胞组移植后第 10 天血糖明显下降,一直维持到 31 d,胰岛素水平增高,葡萄糖耐量得到明显改善,而腹腔 - 胰岛样细胞组移植后血糖、胰岛素水平、葡萄糖耐量均未见明显改善,与预想实验结果有较大差异。通过观察腹腔 - 胰岛样细胞组血糖曲线可以发现移植后小鼠血糖大幅升高,直至 1周后才开始下降,此后血糖水平略低于糖尿病组。作者推测前期血糖升高可能是腹腔注射“异物”引起的应激性反应所致,导致相应细胞因子的释放,致使血糖调控进一步受到影响 [27]。腹腔移植胰岛样细胞治疗效果较差可能与以下原因有关:①诱导分化过程中,人脐带间充质干细胞的低免疫原性发生改变 [28-29];②胰岛样细胞在新的微环境下具有一定免疫原性,致使单核巨噬细胞 ( 先天免疫 ) 的激活和免疫细胞浸润 [18];③腹膜腔具有独特的免疫特性,并含大量免疫细胞 [30];④移植的胰岛样细胞数目较少 [19]。对于尾静脉移植方式,应该也存在一定的免疫排斥,只是在反应的时效、强度、路径和免疫调节等多个方面与腹腔途径存在差异,以至于在观察期内胰岛样细胞还是发挥了一定降糖作用,这有待对其进一步研究。
综上所述,腹腔直接移植胰岛样细胞并不是一个好的移植方法。这与 EL-TANTAWY 等 [19] 报道不一致,可能由于诱导过程中人脐带间充质干细胞的低免疫原性改变和胰岛样细胞数目移植较少有关。因此为了提高腹腔移植效率,可以通过免疫抑制剂联合胰岛样细胞共同治疗糖尿病 [31],也可以使用新型水凝胶包裹胰岛样细胞 [32],降低免疫排斥反应。有理由相信在不久的将来,干细胞治疗糖尿病的效果会越来越好。
作者贡献:实验设计为傅松涛、解军、郭璇,实验实施为郭璇、索金荣、李英蕊,实验评估为黄磊、马牧南、李静静,资料收集及成文为郭璇,审校为傅松涛。
经费支持:该文章接受了“山西省‘1331 工程’重点学科建设计划经费”“山西省国际科技合作基金 (201703d421022)”“山西省重点研发计划 ( 国际科技合作 )(201903D421023)”的资助。所有作者声明,经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
利益冲突:文章的全部作者声明,在课题研究和文章撰写过程中不存在利益冲突。
机构伦理问题:实验方案经山西医科大学实验动物伦理委员会批准,批准号为 SCXK( 晋 )2015-0001。实验过程遵循了国际兽医学编辑协会《关于动物伦理与福利的作者指南共识》和本地及国家法规。
知情同意问题:脐带组织来源于山西医科大学附属第一医院产科健康婴儿脐带组织,经产妇及家属知情同意并已签署知情同意书。
写作指南:该研究遵守国际医学期刊编辑委员会《学术研究实验与报告和医学期刊编辑与发表的推荐规范》。
文章查重:文章出版前已经过专业反剽窃文献检测系统进行 3 次查重。
文章外审:文章经小同行外审专家双盲外审,同行评议认为文章符合期刊发稿宗旨。
生物统计学声明:文章统计学方法已经通过山西医科大学生物统计学专家审核。
文章版权:文章出版前杂志已与全体作者授权人签署了版权相关协议。
开放获取声明:这是一篇开放获取文章,根据《知识共享许可协议》“署名 - 非商业性使用 - 相同方式共享 4.0”条款,在合理引用的情况下,允许他人以非商业性目的基于原文内容编辑、调整和扩展,同时允许任何用户阅读、下载、拷贝、传递、打印、检索、超级链接该文献,并为之建立索引,用作软件的输入数据或其它任何合法用途。
4 参考文献 References
[1]VERES A, FAUST AL, BUSHNELL HL, et al. Charting cellular identity during human in vitro β-cell differentiation. Nature. 2019;569(7756):368-373.
[2]RUSS HA, PARENT AV, RINGLER JJ, et al. Controlled induction of humanpancreatic progenitors produces functional beta-like cells in vitro.EMBO J. 2015;34(13):1759-1772.
[3]AMERICAN DIABETES ASSOCIATION. Economic costs of diabetes in the U.S. in 2012. Diabetes Care. 2013;36(4):1033-1046.
[4]FRYER BH, REZANIA A, ZIMMERMAN MC. Generating β-cells in vitro: progress towards a Holy Grail. Curr Opin Endocrinol Diabetes Obes. 2013;20(2):112-117.
[5]STEPHENS CH, ORR KS, ACTON AJ, et al. In situ type I oligomeric collagen macroencapsulation promotes islet longevity and function in vitro and in vivo. Am J Physiol Endocrinol Metab. 2018;315(4): E650-E661.
[6] LENNON DP, EDMISON JM, CAPLAN AI. Cultivation of rat marrowderived mesenchymal stem cells in reduced oxygen tension: effects on in vitro and in vivo osteochondrogenesis. J Cell Physiol. 2001;187(3):345-355.
[7]PITTENGER MF, MACKAY AM, BECK SC, et al. Multilineage potential of adult human mesenchymal stem cells. Science. 1999;284(5411): 143-147.
[8]HAKUNO D, FUKUDA K, MAKINO S, et al. Bone marrow-derived regenerated cardiomyocytes (CMG Cells) express functional adrenergic and muscarinic receptors. Circulation. 2002;105(3): 380-386.
[9]JIANG J, AU M, LU K, et al. Generation of insulin-producing islet-like clusters from human embryonic stem cells. Stem Cells. 2007;25(8): 1940-1953.
[10] WANG H, QIU X, NI P, et al. Immunological characteristics of human umbilical cord mesenchymal stem cells and the therapeutic effects of their transplantion on hyperglycemia in diabetic rats. Int J Mol Med. 2014;33(2):263-270.
[11] YU S, CHENG Y, ZHANG L, et al. Treatment with adipose tissue-derived mesenchymal stem cells exerts anti-diabetic effects, improves longterm complications, and attenuates inflammation in type 2 diabetic rats. Stem Cell Res Ther. 2019;10(1):333.
[12] TSAI PJ, WANG HS, LIN GJ, et al. Undifferentiated Wharton’s Jelly Mesenchymal Stem Cell Transplantation Induces Insulin-Producing Cell Differentiation and Suppression of T-Cell-Mediated Autoimmunity in Nonobese Diabetic Mice. Cell Transplant. 2015;24(8):1555-1570.
[13] HU J, WANG Y, WANG F, et al. Effect and mechanisms of human Wharton’s jelly-derived mesenchymal stem cells on type 1 diabetes in NOD model. Endocrine. 2015;48(1):124-134.
[14] CHAO KC, CHAO KF, FU YS, et al. Islet-like clusters derived from mesenchymal stem cells in Wharton’s Jelly of the human umbilical cord for transplantation to control type 1 diabetes. PLoS One. 2008;3(1):e1451.
[15] 山霞 , 崔晓兰 , 时瀚 , 等 . 人脐带间充质干细胞诱导分化不同阶段的胰岛样细胞移植治疗糖尿病 [J]. 中国组织工程研究 , 2017,21(29):4703-4708.
[16] YU YB, BIAN JM, GU DH. Transplantation of insulin-producing cells to treat diabetic rats after 90% pancreatectomy. World J Gastroenterol. 2015;21(21):6582-6590.
[17] PRABAKAR KR, DOMÍNGUEZ-BENDALA J, MOLANO RD, et al. Generation of glucose-responsive, insulin-producing cells from human umbilical cord blood-derived mesenchymal stem cells. Cell Transplant. 2012;21(6):1321-1339.
[18] 李兰兰 , 李宁 , 杨晓菲 , 等 . 人脐带间充质干细胞分化为胰岛素 分泌细胞的免疫原性变化 [J]. 中国组织工程研究 ,2018,22(13): 2045-2050.
[19] EL-TANTAWY WH, HALEEM EN. Therapeutic effects of stem cell on hyperglycemia, hyperlipidemia, and oxidative stress in alloxan-treated rats. Mol Cell Biochem. 2014;391(1-2):193-200.
[20] LI B, CHENG Y, YU S, et al. Human Umbilical Cord-Derived Mesenchymal Stem Cell Therapy Ameliorates Nonalcoholic Fatty Liver Disease in Obese Type 2 Diabetic Mice. Stem Cells Int. 2019;2019: 8628027.
[21] DAVIES JE, WALKER JT, KEATING A. Concise Review: Wharton’s Jelly: The Rich, but Enigmatic, Source of Mesenchymal Stromal Cells. Stem Cells Transl Med. 2017;6(7):1620-1630.
[22] 杨文英 . 中国糖尿病的流行特点及变化趋势 [J]. 中国科学 : 生命科 学 , 2018, 48(8):812-819.
[23] TAN K, ZHENG K, LI D, et al. Impact of adipose tissue or umbilical cord derived mesenchymal stem cells on the immunogenicity of human cord blood derived endothelial progenitor cells. PLoS One. 2017;12(5):
[24] DING DC, CHANG YH, SHYU WC, et al. Human umbilical cord mesenchymal stem cells: a new era for stem cell therapy. Cell Transplant. 2015;24(3):339-347.
[25] CORSELLO T, AMICO G, CORRAO S, et al. Wharton’s Jelly Mesenchymal Stromal Cells from Human Umbilical Cord: a Close-up on Immunomodulatory Molecules Featured In Situ and In Vitro. Stem Cell Rev Rep. 2019;15(6):900-918.
[26] BARCZEWSKA M, GRUDNIAK M, MAKSYMOWICZ S, et al. Safety of intrathecal injection of Wharton’s jelly-derived mesenchymal stem cells in amyotrophic lateral sclerosis therapy. Neural Regen Res. 2019; 14(2):313-318.
[27] ROUSHANDEH AM, BAHADORI M, ROUDKENAR MH. Mesenchymal Stem Cell-based Therapy as a New Horizon for Kidney Injuries. Arch Med Res. 2017;48(2):133-146.
[28] LEE HJ, KANG KS, KANG SY, et al. Immunologic properties of differentiated and undifferentiated mesenchymal stem cells derived from umbilical cord blood. J Vet Sci. 2016;17(3):289-297.
[29] 杨大威 , 林和敏 , 刘广鹏 . 成骨分化的人脐带血间充质干细胞免疫原性研究 [J]. 中国修复重建外科杂志 ,2014,28(6):752-757.
[30] 刘志刚 , 张万华 , 刘霆 . 腹膜腔细胞的免疫特性及功能研究进展 [J].重庆医学 ,2019,48(14):2467-2470.
[31] 郭波 , 刘佳 , 崔晓兰 , 等 . 人脐带间充质干细胞联合免疫干预治疗1 型糖尿病小鼠的实验研究 [J]. 中国组织工程研究 , 2019,23(13):2016-2021.
[32] MACLEAN FL, IMS GM, HORNE MK, et al. A Programmed Anti Inflammatory Nanos caffold (PAIN) as a 3D Tool to Understand the Brain Injury Response. Adv Mater. 2018;30(50):e1805209.
本文献包括图片转载于中国组织工程研究杂志|第25卷|第1号|2021年1月,不代表本网站赞同其观点和对其真实性负责,我们主要用于阅读分享,非商业用途,如若侵权,请告知删除。