皮肤缺损在是一种常见的组织损伤性疾病。目前,对于中重度烧伤的患者应用自体植皮是首选的治疗方案[1-2],但是对于大面积烧伤患者,自体供皮不足是临床中碰见的最棘手的问题,所以人们一直在寻找一种永久性皮肤替代物3。人工皮肤是与皮肤结构有一致生理活性的蛋白质复合材料,但是人工皮肤价格昂贵,不同情况下要使用不同的人工皮肤。如今,成纤维细胞的培养技术已经日臻完善:在组织工程领域,为表皮细胞提供支持,提高创面愈合质量方面亦开展了多方面的研究4-6。
1975年Rheinwald等首次在体外连续培养人类表皮细胞,并获得了成功,近年来成为组织工程中的一个研究热点;表皮细胞悬液培养方式的移植77]也克服了膜片移植的某些缺陷8,随着现代细胞生物学的发展,表皮细胞悬液的移植培养使表皮替代物的构建成为可能9]。
1材料和方法
1.1实验动物与分组:选取成年健康Wistar大鼠40只(购于广西医科大学动物实验中心),体重约200~3009,雌雄各半。随机分为A(实验组)和B(对照组)两组,每组各20只。
1.2术前准备:随机选取大鼠20只作为实验组A,其余20只为对照组。术前禁食6h,予以10%水合氯醛(O.3ml/lOOg)腹腔注射麻醉。供皮区选择皮肤正常的左侧背部皮肤,固定好大鼠,消毒后,刮除背部鼠毛,形成约2cm×2cm无毛区,周围用胶带黏贴。
1.3表皮细胞悬液的制备:无菌条件下取左侧背部全厚皮片,大小约0.7cm×0.5cm,皮肤供区部位分层缝合。获取的皮肤组织用PBS漂洗2遍,去除皮下组织,剪成0.2cm×0.2cm小块,加Dipase I溶液,4℃消化过夜。用尖镊分离出表皮细胞,PBS漂沈,剪碎加入0.25%胰蛋白酶和0.01%EDTA 1:1混合液,37℃消化lOmin,加入血清终止消化,吸管反复吹打分散细胞,再用100目的尼龙筛网过滤去除没有完全消化的细胞膜片,离心弃上清,加入含有15%胎牛血清、表皮生长因子l0 ug/L的MEM培养液,置37℃、5%饱和湿度恒温培养箱中培养,隔日换液1次。细胞密度达60%~70%时,按1:3比例传代。再次经离心洗涤2次,台盼兰染色活细胞率>95%,用血细胞计数板调整表皮细胞最终浓度约7×106/ml备用。
1.4鉴定:取制备好的表皮细胞悬液,电镜观察发现该表皮细胞的数量和活力均较好。分离后的表皮细胞接种到培养皿后,早期的细胞呈圆形或椭圆形,单个或成团的悬浮于培养基中,3~6 h后便以单个或细胞团簇沉于瓶底,24h后大部分的表皮细胞开始贴附于瓶底生长。表皮细胞贴壁后成多角形,细胞核成圆形,细胞外观透明,呈典型的铺路石样生长。并且表皮细胞抗角蛋白抗体染色呈(十),抗波形蛋白抗体染色呈(一),即可证明本实验中所分离出的细胞为表皮细胞。
1.5移植:将实验组A老鼠右侧背部皮肤作为移植表皮细胞悬液受区。将术区用2%利多卡因局麻后,用皮肤磨削机打磨表皮,至皮肤创面出现针尖样出血点1.Ocm×1.0cm。将所制备好的浓度约7×106/ml表皮细胞悬液以播种密度为1.4×10s/cm2均匀涂于打磨后的白体受区,使移植细胞均匀分布,用纱布包扎固定,注意避免敷料移动,7天后去除包扎纱布。对照组B仅以纱布覆盖,包扎固定,不加以任何表皮细胞悬液。术后每只大鼠给予青霉素以40 000IU/1009肌肉注射4日预防感染,给予常规饲料,单笼隔离喂养。
1.6观察指标
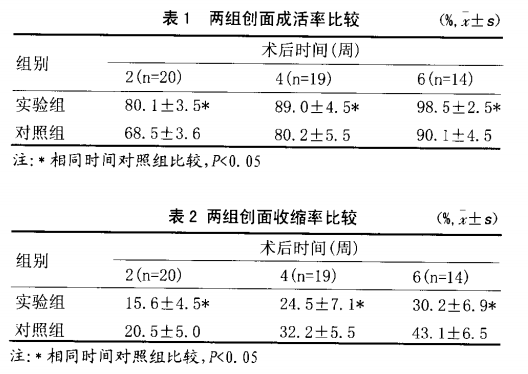
1.6.1大体观察:术后动态观察两组大鼠是否发生感染,发生感染的例数,两组创面愈合情况,创面植皮成活率和收缩率等。计算术后2、4和6周大鼠移植物成活率和收缩率,计算方法参照文献10]:

1.6.2创面修复后的皮肤功能检查:皮肤弹性可通过2种方法获得:①食指和中指捏起皮肤的高度;②指压反应。柔软性通过触摸得知。
1.7统计学分析:采用统计软件SPSSl3.0进行统计分析。术后2、4、6周创面收缩率均值比较用Anova检验,两两比较用LSD法。相同时间对照组与实验组之间收缩率均值比较用成组设计t检验,P≤0.05为差别有统计学意义。
2结果
2.1 A、B两组人鼠皮肤创面愈合情况:A组人鼠的创面愈合,虽然有局部皮肤收缩,但是创面收缩的程度很轻,愈合良好,未见明显的瘢痕组织形成。而B组创面出现不同程度的皮肤收缩,程度不等的瘢痕组织,而且色素沉着明显较实验组严重。A在创面愈合后为完好的上皮组织,柔软、光滑,并有纤细的绒毛牛长,较B组创面美观、光滑。
2.2移植后表皮细胞靠创面的渗出液得到营养,保持其增殖能力,表皮细胞经过增殖、分化,逐渐形成新的表皮。移植后第7天可见创面上形成薄薄的上皮,伤口表面覆盖新鲜细嫩的表皮组织,红润有光泽。创面可见“皮岛”出现,“皮岛”呈离心性生长,逐渐与向心性生长的周边皮肤融合。第9天,创面大部分上皮化,无水泡及表皮坏死现象。术后14天,移植治疗的表皮细胞进一步成熟和分化,表皮层逐渐增厚,创面愈合良好,无明显结痂的出现,极少部分出现色数沉着。至第28天,皮肤缺损创面已完全愈合,无明显瘢痕形成。至42天时,色素沉着亦明显减退,新生皮肤上皮层较厚、柔软、耐摩擦、有一定弹性,外观较接近鼠脱毛后的正常皮肤。而与之对比的B组大鼠创面的愈合过程是:在第7天亦可见创面上形成少量薄薄的上皮;但第9天时只是部分上皮化,结痂:第14天可见创面进一步呈收缩姿态,结痂亦脱落,实验区呈白色;至第28天,实验区色素沉着较实验组明显,而且42天时色素沉着仍然很明显,新生皮肤上皮层薄、易破溃,皮肤弹性亦不如实验组。
3讨论
通过实验可明显看出,自体表皮细胞悬液在移植修复表皮缺损创面时,能够促进皮肤缺损创面的愈合速度,减轻创面的收缩率,预防瘢痕形成,减轻伤后色素沉着进而影响美观。自体表皮细胞增生,并通过细胞与细胞间接触或释放各种生物活性因子对表皮重建及创面愈合起了生物促进作用嘲。相对比之下,异体细胞在创面排异反应是否存在,自今仍有争议11-12。
无载体进行自体表皮细胞悬液修复表皮创面缺损的情况时,为了减少所移植细胞的流失,术后应该等待20~60min,直到细胞液体被创面吸收后再用凡士林薄纱条包扎固定。
伤口创面的修复由各种皮片,皮瓣移植发展至自体微粒皮移植:直到最近十余年逐渐发展起来的表皮细胞培养,此项技术已成为临床医学及医学牛物工程领域中的热点。表皮细胞悬液培养,首先把表皮细胞置于无菌环境中培养,制备成表皮细胞悬液,从而减少了植皮失败的几率;其次表皮细胞回植到自体皮肤缺损创面,从而加速其分裂增殖,达到加速创面愈合的目的。
本方法供皮区面积小,创面愈合快,直接种植方法简便,易于操作。并可根据刨面大小,适当增加取度量和取血量,以增加细胞的数目,便于细胞留种、种植、成活,缩短创面愈合时问;并且具有供皮区小,受区面积大的优点。
制备好的表皮细胞经体外培养和传代培养,可得到大面积的表皮细胞。移植时可将培养载体从培养瓶中取出,使表皮细胞均匀分布于皮肤缺损创面,1周后,可见移植创面长满培养的表皮细胞。经实验证明,有很好的疗效。因此,综合大量文献41可得:以正常皮肤作为培养皮肤细胞来源。通过增殖器不仅达到扩大表皮面积目的,而且能较快地修复创面,有很好的实用价值和发展前景。因此,在皮源不足时,表皮细胞培养对于大创面的修复有很重要的意义;尤其对有瘢痕体质如瘢痕疙瘩患者,用一般的植皮容易再发瘢痕疙瘩,而培养的自体表皮细胞就可能避免这种缺陷。
该实验的缺点是表皮细胞悬液在移植治疗皮肤缺损过程中因为自身流动的原因21,不能局限于创面上或者是各种原因出现细胞脱落等问题,从而不能发挥最大的作用。所以目前许多学者提出以胶原海绵22,脱细胞真皮基质为载体移植表皮细胞悬液23。表皮干细胞的应用24],组织工程皮肤的修复重建25等等。另外,由于表皮细胞悬液移植后需要一定时期创面内培养,且培养对创面要求比较高,稍有感染将导致细胞成活失败。故目前仅能在较小面积创面上应用,存在一定的局限性。
[参考文献]
[1]Anderson JM,Rodriguez A,Chang DT Foreign body reaction to biomaterial[J].Semin Immunol,2008,20(2):86.100.
[2]Anderson JM.Inflammatory response to implants[J] ASAIO Trans,1998,34(2):101—107.
[3]Prasad CK,Krishnan LK.Reglulation of endothelial cell phenotype by biomimetic matrix coated on biomaterials for cardiovascular tissue engineering[J].ActaBiomater,2008,4(1):182—191.
[4]Shibata H,Shioya N,Kuroyangi Y.Development of new wound dressing composed of spongy collagen sheet containing dibutyryl cyclic AMP[J].J Biomater Sci Polym Ed,1997,8(8):601—621.
[5]HafemannB,Ensslen S,Erdmann C,et a1.Use of a collagen/elastin—membrane for the tissue engineering of dermis[J]. Bums,1999,25(5):373-384.
[6]贾赤宇,陈璧,Arnold F.不同分子量的高纯度透明质酸对猪去全厚皮后伤口愈合的影响[J]中国修复重建外科杂志,1998,8(8),601一604.
[7]Maeda M,Kadota K,Kajihara M,et a1.Sustained release of human growth hormone(hGH)from collagen film and evaluation of effect on wound healing in db/db mice[Jl_J Control Release,200 l,77(3): 261.272.
[8] 吕国忠,朱宁刚,周红梅,等.tI异体表皮混合体内培养的实验研究[J]中华烧伤杂志,2003,19(8):29—31.
[9]高文娟,张逸,鲁双云,等.表皮细胞培养及其临床应[J].中国组织工程研究与临床康复,2007,11 (7):1349—1352.
[10]柴家科,刘强,冯瑞等.异种(猪)去细胞真皮基质与自体微粒皮及自体刃厚皮复合移植的比较研究[J]解放军医学杂志,2004,29(8):714—716.721.
[11]Horch RE,Debus M,Wagner G.et a1.Cultured human keratinocytes on type I collagen membranes to reconstitute the epidermis[J].Tissue Eng,2000,6(1):53—67.
[12]Ronfard V,Rives JM,Neveux human epidermis on third Y,et a1.Long—term regeneration of degree bums transplanted with autologous cultured epithelium grown on a fibrin matrix[J].Transplantation,2000,70(1 1):1588一1598.
[13]Phillips TJ Cultured epidermal allografls—a permanent or temporary solution[J].Transplantation,1991,51(5):937.941.
[14]Kremer M,Lang E,Berger A.Organotypical engineering of differentiated composite—skin equivalentsof human keratinocytes in a collagen—GAG matrix(INTEGRA Aritificial Skin)in a perfusion culture system[J].Langenbecks Arch Surg,2001,386(5):357—363.
[1 5]Berthod F,Germain L,Li H,et a1.Collagen fibril network and elastic system remodeling in a reconstructed skin transplanted on nude mice[J].Matrix Boil,2001,20(7):463—473.
[16]Xiao SC,Zhu SH,Li HY,et al Feasibility study of composite skin reconstructed by mixing keratinocytes and acellular dermal matrix forwound repair[J]swissmedwkly,2009,139(1.2):16.21.
[17]Lim IJ,Phan TT,Bay BH,et a1.Fibroblasts cocultured with keloid keratinocytes:Normal fibroblasts secrete collagen in a keloidlike manner[J].Am J Physiol Cell Physiol,2002,283(1):C212-22.
[18]Syed F,Ahmadi E,Iqbal SA,et a1.Fibroblasts from the growing margin of keloid scars produce higher levels of collagen I and III compared with intralesional and extralesional sites:clinical implications for lesional site—directed therapy[J]Br J Dermatol, 2010.164(1:83—96
[1 9]Chung HJ,Steplewski A,Chung KY,et al Collagen fibril formation,A new target to limit fibrosis_[J]J Biol Chem,2008,283(38): 25879.25886.
[20]Durani P,Bayat A.Levels of evidence for the treatment of keloid disease[J].JPlastReconstrAesthet Surg.2008.61(1):4—17.
[21]Rheinwald JG;Green H Serial cultivation of strains of human epidermal keratinocytes:the formation of keratinizing colonies from single cells[J].Cell,1975,6(3):33 1—336.
[22]王碧,王坤余,叶勇,等.胶原材料在药物缓释和组织工程中的研究进展[J].中国修复重建外科杂志,2004,18(2):112.114.
[23]周宁,陈骅.脱细胞异体真皮加自体表皮复合移植20例[J].河北医药,2005,27(5):372—373.
[24]李丹,李世荣,曹川.人表皮干细胞在成人及胎儿不同部位皮肤中的比较研究[J]中国美容医学.2007,16(10):1343一1346.
[25]张琼,王乃佐,陈辉,等.组织工程皮肤修复全层皮肤缺损的实验研究[J].中吲修复重建外科杂志,2008,22(2):196—200.
本文献包括图片转载于中国美容医学2012年12月第21卷第12期(上),不代表本网站赞同其观点和对其真实性负责,我们用于阅读分享,非商业用途,如若侵权,请告知删除。


