游离皮片移植技术是目前治疗深度烧伤创面的主要方法。对于Ⅲ度烧伤创面,切痂后在血运良好、界线清楚的深筋膜层植皮,皮片成活率较高。然而,对于深Ⅱ度和部分脂肪组织并未全层受累的Ⅲ度烧伤创面,笔者团队一直主张在行削痂术时,需将坏死痂皮及残留真皮完全削除,从而避免残存的真皮感染[1]。而且,出于保护组织外形和良好功能的需要,保留健康脂肪组织,在脂肪断层表面植皮。然而,脂肪组织血运较差,有可能发生感染、液化,导致植皮成活率不高。因此,如何提高在脂肪断层移植皮片的成活率是临床中亟需解决的难题。
随着细胞分离培养、细胞喷洒技术的研究,自体细胞再生技术出现并在临床开始应用[2]。该技术无需在体外进行细胞培养,术中即可完成,可满足1:80(每1cm2皮片制备的细胞悬液可应用于80cm2的创面)的比例应用于自体创面[3]。目前该技术已广泛应用于临床,包括直接应用于烧伤、创伤等急性创面[3],瘢痕、色素性疾病修复[4],课题组前期将该技术应用于供皮区[5],慢性创面[6]等,取得了良好的效果。如果将自体细胞再生技术结合自体皮片移植应用于深度烧伤创面,有望可以进一步提高植皮成活率,促进创面愈合。
为了解自体细胞再生技术结合自体皮片移植在深度烧伤创面的临床效果,我科自2014年3月-2018年3月选取住院的深度烧伤患者54例,分为实验组和对照组,其中实验组患者将自体细胞再生技术结合自体皮片移植,与对照组单纯用自体皮片移植的患者相比,取得了良好的临床效果。
1 对象与方法:
1.1入选标准
(1)年龄≥18岁,性别不限;(2)烧伤总面积10%-30%TBSA且深Ⅱ度或Ⅲ度烧伤≥5%TBSA。
1.2 临床资料
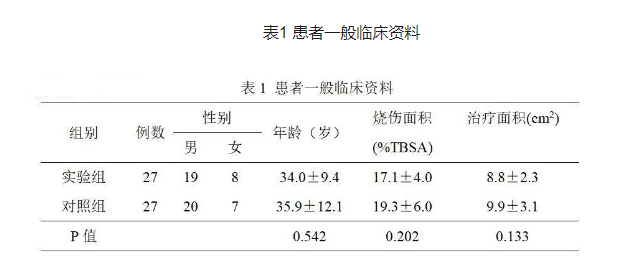
收集我院烧伤科2014年3月至2018年3月共54例深度烧伤患者,包括男39例,女15例,年龄18~55岁。其中,接受自体细胞再生技术结合自体皮片移植组(包括邮票皮、网状皮、大张皮片)27例,每种植皮方法9例,年龄为18-55岁,接受自体皮片移植组(包括邮票皮、网状皮、大张皮片)27例,每种植皮方法9例,年龄为18-53岁。两组患者年龄、性别、烧伤面积、治疗面积和供皮区面积比较差异均无统计学意义(P>0.05)。
1.3 治疗方法
2组患者均在有效抗休克,各项生命体征平稳后,于伤后5天内行手术治疗。手术部位位于肢体,采用辊轴刀行削痂术。常规在肢体根部上止血带进行手术,根据受伤范围,用辊轴刀削除焦痂及痂下失活脂肪组织至健康脂肪组织。健康脂肪组织指色淡黄、有光泽、呈点状出血创面。生理盐水纱湿敷创面。
实验组患者头部供皮区消毒后,皮下注射含肾上腺素生理盐水以减少出血并便于取皮。按课题组此前报道方法[5-6]获取自体表皮基底细胞悬液。将自体表皮基底细胞悬液喷洒于创面后,行自体邮票皮或网状皮或大张皮片移植。对照组患者不喷洒自体细胞,直接行自体邮票皮或网状皮或大张皮片移植。其中,两组邮票皮或网状皮扩张比率不超过1:2。术毕松开止血带, 检查肢体末梢血液循环是否良好。
术后根据临床需要应用抗生素。术后3天第一次换药,随后隔天换药,直至创面愈合。以创面上皮化为愈合标准,记录创面愈合时间[6]。术后2周、4周、3个月、6个月定期复诊,观察植皮区愈后瘢痕增生、瘙痒等情况。
1.4 统计学分析
应用SPSS 16.0统计学软件进行数据分析。创面愈合时间、烧伤面积和治疗面积用均数±标准差(x()s)表示,视方差齐性情况均值比较用t检验或非参数检验U检验,评分用非参数检验U检验,α<0.05 为检验水准。
2 结果
2.1 创面愈合时间:
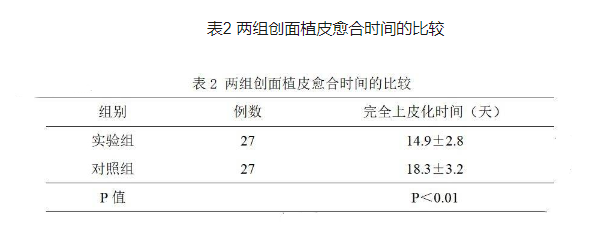
植皮创面愈合时间实验组比对照组平均提前约3.4天,差异有统计学意义, P<0.0l,详见表2。
2.2创面愈合率:
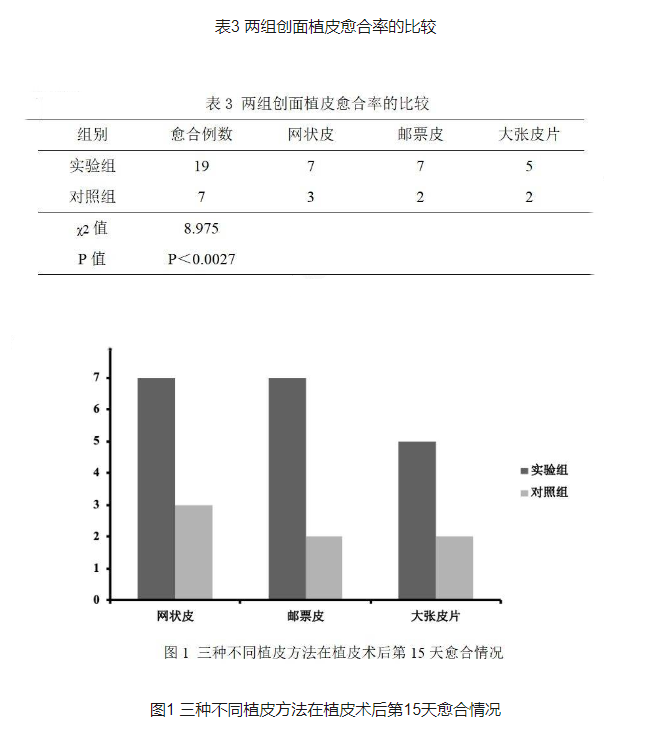
创面在植皮术后第15天,观察创面愈合率,实验组共有19例患者创面愈合,对照组共有7例患者愈合,差异有统计学意义, P<0.0l,详见表3、图1。
2.3 创面疼痛情况
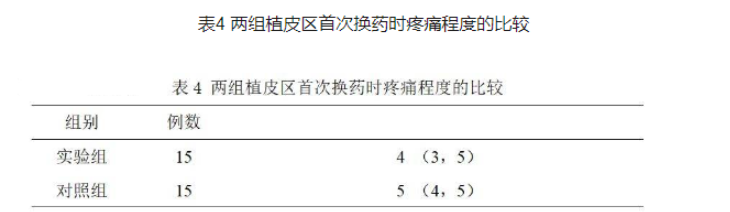
两组术后首次换药疼痛程度判定:0-10分。两组疼痛程度得分的人数(见表4),统计学分析结果显示两组疼痛程度差异无统计学意义(P>0.05)。

2.4创面并发症
两组创面均无出现植皮坏死、皮下血肿等并发症。实验组有2例植皮感染,而对照组则有4例,两组感染率比较差异无统计学意义(P>0.05)。通过常规换药,感染均得到有效控制,最后创面完全愈合,无需二次植皮。
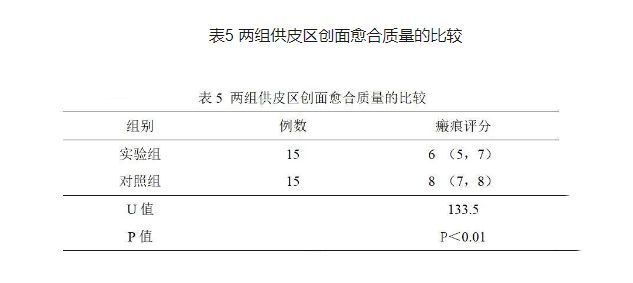
2.5创面愈合质量
所有患者均进行了为期6个月的随访。实验组温哥华瘢痕评定量表中位评分为6分,对照组温哥华瘢痕评定量表中位评分为8分,两组比较差异有统计学意义(P<0.01)(见表5)。
2.6 典型病例(图2):
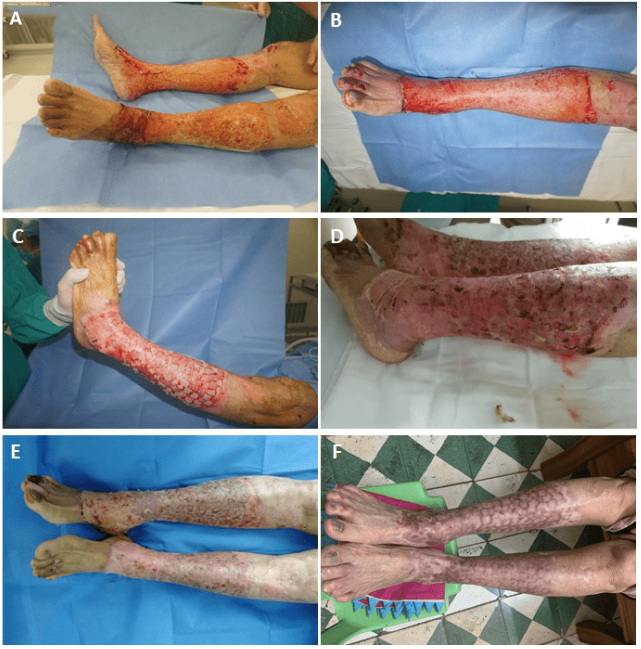
图2 A.术前双下肢烧伤创面;B. 术中削痂;C. 术中削痂后行自体基底细胞喷洒,邮票皮移植;D. 术后1周换药,见创面大部分移植皮片成活,无坏死,无移位,无感染,皮片间散在创面;E. 术后2周换药,见创面移植皮片成活;F. 术后6月复诊,移植皮片成活良好,皮片间有少许边缘瘢痕形成,色泽红,质韧,无破溃。未见有感染、过敏等不良反应。
3 讨论
与单纯植皮相比,应用自体细胞再生技术结合植皮治疗削痂后的烧伤创面,愈合时间更短,而且在更换敷料时疼痛更少,安全性好,无明显皮片坏死、皮下血肿、感染等并发症,远期疗效更佳,愈合质量理想。
移植皮片的成活需要良好的血运支撑。由于脂肪组织血供相对不足、抗感染能力低,削痂后植皮的成活率明显低于切痂后的植皮成活率。因为切痂后,在血运丰富的深筋膜上植皮,能确保移植皮片成活。然而,切痂后皮下缺乏脂肪组织将直接影响患肢的外形与功能,导致愈合质量差,外观不饱满、皮肤不耐磨、容易反复破溃,瘢痕收缩明显等一系列的问题。在削痂后保留皮下健康脂肪组织,同时又要保证植皮成活率是临床上的难题[7]。
自体细胞再生技术获取的细胞混有多种类型,主要是表皮基底细胞,也包括朗格罕斯细胞、黑色素细胞和成纤维细胞以及表皮干细胞[8]。研究表明,创面周缘及创面基底残存的基底层细胞和棘层细胞是创面上皮化的源细胞,通过这些源细胞的增殖、迁移来修复创面[9]。当创面较小时,基底细胞通过分裂、增殖和分化后向上移行,修复创面;如创面较大,除了创面基底的细胞作用外,创面周缘健存的基底细胞也开始分裂、增殖来启动愈合过程。因此,通过喷涂自体表皮基底细胞至创面,为创面愈合提供了额外的种子细胞,应该可促进创面上皮化、缩短愈合时间。其促进愈合的机制与微粒皮移植相同,即将表皮分化中心数量增加,减小创缘间距,缩短愈合时间。在我们的观察中,实验组创面愈合时间为14.9±2.8天,与对照组相比,愈合时间明显缩短,差异有统计学意义,有效提高了在削痂后创面移植皮片的成活。并且,在植皮术后第15天分析两组的植皮成活率,实验组的成活率显著高于对照组,提示应用了自体细胞再生技术后,可以有效加速植皮成活,有利于促进创面愈合。但是,各种植皮方式仍然存在一定的差别,从本组病例来看,网状皮和邮票皮的成活率较大张皮片移植高,可能与大张皮片引流稍差的原因有关。尽管在统计学上比较没有差异,可能是与亚组分析后各种植皮方式纳入病例数偏少有关,有待日后扩大病例数深入研究。
进一步在表皮基底细胞上进行皮片移植,除了通过直接植皮封闭创面外,皮片之间的创面可以通过表皮基底细胞促进愈合。同时,应用细胞悬液喷洒创面,除了具有传统皮片移植的细胞由周围向中心生长发展的作用,还具有了由创面基底向移植自体皮片的由下往上生长的作用。由此,细胞两种生长方式同时发展,加速了创面的愈合,改变了传统皮片移植的生长方式。另外,处于移植皮片下的表皮基底细胞,在创面的微环境中,可能可以分泌胶原酶来分解阻碍创面愈合的坏死和纤维化组织。而且,自体细胞再生技术制备的细胞悬液主要来源于基底层,含有数量可观的表皮干细胞,可能会有利于血管新生,保证了血液及营养的供应,从而加速创面愈合。目前研究表明,皮肤附属结构(如汗腺、皮脂腺、毛发、感觉器官等)的修复再生与表皮干细胞有着密切的关系。增加的表皮干细胞有可能在创面微环境的诱导下,也能相应改善创面愈后相关皮肤功能。这些具体的机制也是我们日后进一步研究和验证的方向。
自体细胞再生技术的一大特点是不额外增加供皮区面积,符合以最小的供区来最大限度地封闭创面的原则。大量的研究表明[10],应用自体细胞再生技术,可以以小供皮区来治疗大面积烧伤和创面。将该技术应用于大面积烧伤患者,将能进一步发挥其优越性。
在加快创面愈合和皮片贴服创面的同时,理论上也会减轻换药时的疼痛以及减少创面并发症。与对照组单纯皮片移植相比,结合了自体细胞再生技术后,创面的愈合速度加快,上皮化形成快,可减少内层敷料与皮片间创面的粘连,从而减轻了换药时的疼痛等不适。但是,在本研究中,两组患者在植皮术后首次换药时,疼痛评分并无显著性差异,可能与网状皮、邮票皮移植的特点有关,皮片之间存在缝隙,一定程度上与内层敷料粘连从而引起疼痛不适。但是,随着创面愈合速度加快,其发生感染、皮片坏死、皮下血肿等并发症的可能就越小。本次研究中,实验组与对照组均无皮片坏死、皮下血肿等并发症发生。另外,感染率在两组的比较中,差异也无统计学意义。
创面愈合后瘢痕增生情况主要取决于受损创面的深度和创面修复组织的速度。因此,缩短创面愈合时间是减少和防止瘢痕增生的有效手段,也为后期的肢体功能康复锻炼奠定基础。同时,本组病例均是行削痂术,最大限度地保留了皮下健康的脂肪组织,也为愈后的皮肤质量提供了保证。实验组应用了自体细胞再生技术,有效加快了创面的愈合速度,明显改善了创面瘢痕增生情况。本研究在短期的随访中,观察到与对照组相比,实验组中皮片移植后瘢痕增生程度不明显,温哥华瘢痕评定量表评分明显低于对照组,差异有统计学意义。这可能与表皮基底细胞中含有部分活性成纤维细胞,通过分泌胶原,形成细胞外基质,减少了瘢痕的挛缩。
综上所述,自体细胞再生技术用于深度烧伤创面,与自体皮片移植相结合,可以明显缩短创面愈合时间,减少换药时患者疼痛,远期疗效佳,值得在临床中推广应用。
参考文献:
[1] 朱家源,朱斌,李新强,等,复合皮混合移植治疗深Ⅱ度烧伤患者创面疗效观察[J],中华烧伤杂志,2005, 21(1): 21-23.
[2] Duncan CO, Shelton RM, Navsaria H, et al. In vitro transfer of keratinocytes: comparison of transfer from fibrin membrane and delivery by aerosol spray [J]. J Biomed Mater Res B Appl Biomater, 2005, 73: 221–228.
[3] Bairagi A, Griffin B, Tyack Z, et al. Comparative effectiveness of Biobrane®, RECELL® Autologous skin Cell suspension and Silver dressings in partial thickness paediatric burns: BRACS randomised trial protocol [J]. Burns Trauma. 2019 Oct 31;7:33.
[4] Peirce SC, Carolan-Rees G. ReCell® Spray-On Skin System for Treating Skin Loss, Scarring and Depigmentation after Burn Injury: A NICE Medical Technology Guidance [J]. Appl Health Econ Health Policy. 2019 Apr;17(2):131-141.
[5] Hu ZC, Guo D, Liu P, et al. Randomized clinical trial of autologous skin cell suspension for accelerating re-epithelialization of split-thickness donor sites [J], Brit J Surg, 2017;104:836-842.
[6] Hu ZC, Chen D, Guo D, et al. Randomized clinical trial of autologous skin cell suspension combined with skin grafting for chronic wounds [J]. Brit J Surg, 2015;102(2):e117-23.
[7] 李峰.王宏伟,尹会男,等.削痂后Ⅱ期于脂肪组织层行Meek植皮治疗大面积深度烧伤的临床效果及机制[J].中华烧伤杂志,2019,35(6):446-450.
[8] Wood FM, Giles N, Stevenson A, et al. Characterisation of the cell suspension harvested from the dermal epidermal junction using a ReCell® kit[J]. Burns. 2012; 38(1): 44-51.
[9] Nuutila K, Katayama S, Vuola J, et al. Human Wound-Healing Research: Issues and Perspectives for Studies Using Wide-Scale Analytic Platforms [J]. Adv Wound Care (New Rochelle). 2014; 3(3):264-271.
[10] Holmes Iv JH, Molnar JA, Carter JE, et al. A Comparative Study of the ReCell® Device and Autologous Spit-Thickness Meshed Skin Graft in the Treatment of Acute Burn Injuries [J]. J Burn Care Res. 2018 Aug 17;39(5):694-702.
作者及单位:Myseed麦施缔医疗科研团队(Spray Skin) 首席科学家朱家源教授
免责声明:本文献包括图片转载于搜狐网,不代表本网站赞同其观点和对其真实性负责。我们用于阅读分享,非商业用途,如若侵权,请告知删除。


