为了确保适当愈合,创面需要保证良好的血供、无坏死组织、清除感染,以及需要维持湿润。伤口敷料应该能消除死腔、控制伤口渗出、预防细菌过度生长、保证适当的液体平衡、经济有效且易于患者和/或护理人员操作。由肉芽组织和上皮形成证实的进行性愈合伤口,可进行闭合或者覆盖。
存在许多意味着可改善伤口愈合环境的局部用药物和替代疗法(尽管缺乏数据以支持明确推荐),一些方法在特定情况下可能有用。
医学治疗
抗生素的作用 — 并非所有伤口都需要抗生素治疗,只有表现出临床感染的伤口才需要。尚无已发表的证据支持将抗生素治疗作为非感染性慢性伤口的“预防”治疗,或支持抗生素能提高无临床感染证据的伤口愈合的可能性。需要抗生素治疗的感染的临床体征包括局部症状(蜂窝织炎、淋巴管炎性红线、化脓、恶臭、坏疽、骨外露等)和全身症状(发热、寒战、恶心、低血压、高血糖、白细胞增多、意识模糊)[4]。
血糖控制 — 尽管没有压倒性的临床证据支持短期的血糖控制会直接影响伤口愈合潜能或者会预防感染[4,5],但我们在治疗伤口和感染的实践中,首先进行血糖控制。
有发展为慢性伤口风险的患者常有与免疫功能受损状态有关的伴发疾病(如糖尿病),并且在最初表现可能没有感染的典型全身征象(诸如发热、白细胞增多)。对于这些患者,高血糖症可能是感染的更敏感指标。
伤口清创术 — 有失活组织、污染或者残留缝合材料的伤口在进一步处理前需要清创。急性创伤性伤口可能有不规则的坏死组织边缘或者伤口中有异物,裂开的手术伤口可能有感染性渗出、肠污染物、坏死的肌肉或者筋膜。这些物质通过刺激产生异常金属蛋白酶,并消耗愈合必需的局部资源,妨碍机体愈合。
阻碍伤口对促进愈合的刺激产生充分细胞反应的慢性伤口的特点,包括坏死组织积聚、血管生成减少、组织角化过度、渗出和生物膜形成(即伤口表面的细菌过度生长)[6]。这类伤口需要反复清创,以恢复最佳的伤口愈合环境。
创面预处理有助于受损组织有序修复和再生,并且可能提高专门的伤口治疗产品和高级生物组织替代品的功能[7]。
冲洗 — 用温热、等张(生理)盐水冲洗应是伤口处理的常规步骤[1]。冲洗对减少细菌负荷以及除去疏松的组织非常重要[8,9]。通常无需添加稀释碘液或者其他消毒液(如氯己定和过氧化氢)。因为这些溶液对抗细菌的作用微乎其微,并且其可通过对正常组织的毒性作用而可能阻碍伤口愈合[10-12]。
低压冲洗[如<15磅/平方英寸(pounds per square inch, psi)通常足以去除大多数伤口表面的物质[13]。临床上已证实使用脉冲式冲洗下肢慢性伤口可减少细菌负荷[14]。更高压力的冲洗器可能通过分割疏松结缔组织和增加组织水肿而引起局部组织损伤。
在动物研究中(即使在更高压力水平下),细菌似乎也并不会随冲洗液体进入邻近的组织[15]。在一项实验模型中,高压冲洗比冲洗球冲洗更能减少细菌的水平(平均减少量分别为70% vs 44%),也未增加菌血症的发生率[16]。对于高度污染的伤口,使用更高压力冲洗减少细菌负荷的益处可能超过邻近组织受损的风险。
外科手术 — 锐性切除的清创术使用手术刀或者其他锐性器械(如剪刀或刮匙)以去除失活组织和累积的残留物(生物膜)。对慢性伤口进行锐性切除清创术减少细菌负荷,并刺激伤口收缩和伤口上皮形成[17]。手术清创是去除大面积的坏死组织最适合的选择,且只要有感染证据(蜂窝织炎、脓毒症)都需要。手术清创也适用于处理慢性不愈合伤口以去除感染、处理潜行伤口边缘或者获取深层组织以进行培养和病理[18-20]。
对于活动性感染患者,抗生素治疗应该有的放矢,其选择应根据伤口的细菌培养和药敏试验决定,从而减少细菌耐药性的发生[21,22]。
对于慢性重症肢体缺血患者,为取得成功,手术清创必须与血运重建相结合[23]。
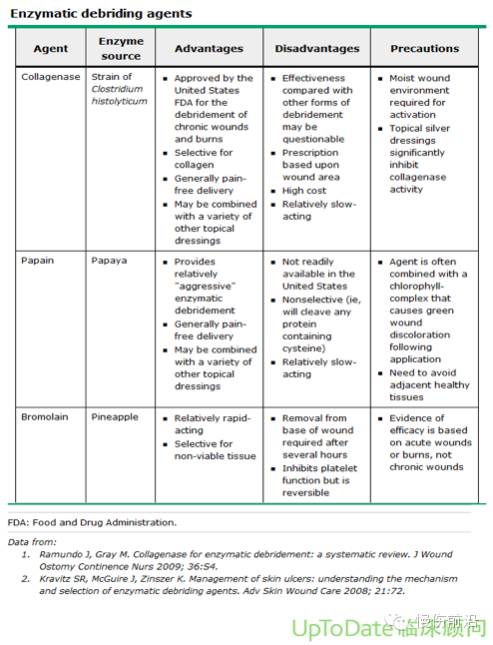
酶法 — 酶清创涉及在伤口处应用外源性的酶类药物。市场上有许多产品可供选择(表 1),但由于临床研究结果不一致,所以其使用仍然存有争议[24]。溃疡愈合率并未随着多数局部药物(包括清创酶)的应用而改善[25]。然而,胶原酶可能以促进内皮细胞和角质形成细胞的迁移从而刺激血管生成和上皮形成作为其作用机制,而非作为严格的清创药物起作用[26]。对于需要清创但不适合外科手的患者,这也仍然是个好选择。
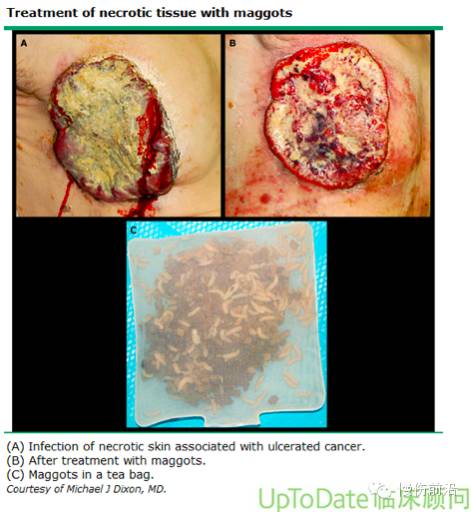
生物法 — 一种伤口清创术的替代方法是使用澳大利亚羊铜绿蝇或丝光绿蝇的幼虫(Medical Maggots™, Monarch Labs, Irvine, CA)[27,28]。蛆虫疗法可作为清创程序间的过渡治疗,或当手术清创不可行或无条件实施时用于慢性伤口的清创。
蛆虫疗法已经用于治疗压力性溃疡[29,30]、慢性静脉性溃疡[31,32]、糖尿病性溃疡[27],以及其他急慢性伤口[33]。蛆虫分泌的蛋白水解酶可以溶解坏死组织,其随后被蛆虫摄取,而留下未受损的健康组织。基础和临床研究表明蛆虫疗法还具有其他益处,包括抗菌作用和刺激伤口愈合[28,31,34]。然而,随机试验结果显示,与标准伤口治疗(如清创术、水凝胶、湿润的敷料)相比,并未发现蛆虫疗法的伤口愈合时间有一致性的减少[35,36]。从费用上看,蛆虫疗法似乎至少与水凝胶相当[36,37]。
敷料更换包括应用周边敷料和网眼状覆盖敷料(雪纺绸),这种网眼状敷料帮助蛆虫进入伤口并限制它们移动(视频 1)。通常每48-72小时更换蛆虫。一项研究评估了在慢性静脉性伤口应用蛆虫疗法,发现持续蛆虫疗法超过一周并无优势[32]。患者被随机分组为蛆虫疗法组(n=58)和常规治疗组(n=61)。在第8日蛆虫疗法组腐肉百分率有统计学意义的高于对照组(67% vs 55%),但在第15日或第30日则没有这种差异。
蛆虫也可置于预制的“生物袋”(可在美国以外买到)中应用(图片 2),方便应用和更换敷料[38-41]。尚未进行对比“自由放养”蛆虫和含有蛆虫的“生物袋”用于伤口清创的随机试验。
蛆虫疗法的主要缺点与患者及工作人员对其使用的负面认识有关。患者的一个顾虑是蛆虫能逃离敷料的可能性,但这很少发生。尽管一项研究发现大约50%的患者表示,比起蛆虫疗法,他们更喜欢传统的伤口治疗,但89%被随机分至蛆虫疗法组的患者说他们会再次接受蛆虫治疗[42]。蛆虫疗法相关的疼痛可能限制了其在约20%患者中的使用[43]。
局部治疗
生长因子 — 对伤口愈合起重要作用的生长因子包括血小板衍生生长因子(platelet derived growth factor, PDGF)、成纤维细胞生长因子(fibroblast growth factor, FGF)和粒细胞巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor, GM-CSF)。已开发出重组人类生长因子,目前正积极研究用其治疗慢性溃疡(主要是累及下肢的溃疡)。
PDGF–贝卡普莱明是一种PDGF凝胶制剂,它能通过促进细胞增殖和血管生成从而改善伤口愈合[44]。它在美国被批准用于糖尿病足部溃疡的辅助治疗,是唯一被批准用于慢性伤口治疗的药物。生长因子通过局部用含水羧甲基纤维素钠凝胶给药。它适用于无感染的糖尿病足部溃疡,而这些溃疡延伸到皮下组织,有充足血运供给[45]。虽然有黑框警告提及对恶性肿瘤的担忧;但认为整体的恶性肿瘤风险低。这种疗法的恶性肿瘤并发症可能反映了使用多个疗程的该药治疗,及已有风险的伤口可能选择性出现转化[46]。上市后研究发现,使用3管或以上贝卡普莱明的患者由恶性肿瘤引发的死亡率比对照组高(3.9/1000人年 vs 0.9/1000人年)[47,48]。
表皮生长因子–在一项对慢性静脉性溃疡的研究中,与安慰剂组对比,人类重组表皮生长因子的局部应用与溃疡面积的更大幅度减少(表皮生长因子组减少7% vs 安慰剂组减少3%)及更高的溃疡愈合率(表皮生长因子组35% vs 安慰剂组11%)相关,但是这些差异并无统计学意义[49]。上皮形成并未受到显著影响。
粒细胞巨噬细胞集落刺激因子–皮内注射GM-CSF能促进慢性腿部溃疡(包括静脉性溃疡)愈合[50,51]。一项试验将60例静脉性溃疡患者随机分为3组,其中2组注射GM-CSF,剂量分别为一次200μg和一次400μg,一周1次,持续4周,另一组给予安慰剂,发现在13周GM-CSF组的愈合率显著高于安慰剂组(分别为57%、61%和19%)[51]。GM-CS已经被用于促进各种慢性伤口的愈合[52]。
消毒剂和抗菌药物 — 大多数局部应用的消毒剂和抗菌产品有刺激性,部分有细胞毒性可导致愈合延迟,并可引起接触性致敏。但这些药物中的两种在特定人群中使用可能有潜在益处:
卡地姆碘(如Iodosorb)是一种抗菌剂,它可以减少伤口中的细菌负荷,并且通过为伤口提供湿润环境而刺激愈合[53]。卡地姆碘对所有革兰阳性和革兰阴性菌都有杀菌作用。对于外用制剂来说,有证据表明卡地姆碘愈合率比标准治疗高。
银对细菌有毒性作用。磺胺嘧啶银乳膏(如Silvadene)是一种局部使用的消毒乳膏,它在皮肤伤口(包括局部增厚的伤口、慢性伤口、皮肤移植供区和烧伤)治疗中降低脓毒症的发生率。含银敷料并没有表现出显著益处。一篇系统评价鉴定出用各种含银的敷料治疗847例受试者的3项试验[54]。一项试验在腿部溃疡患者中比较了含银泡沫敷料(Contreet)与吸水泡沫辅料(hydrocellular foam)(Allevyn™痊愈妥或爱立敷)。第2项试验比较了含银藻酸盐敷料(Silvercel®)与单纯的藻酸盐敷料(Algosteril®)。第3项试验在慢性伤口患者中比较了含银泡沫敷料(Contreet)与最佳局部治疗。与最佳局部治疗中不含银的敷料相比,未发现含银泡沫敷料在使用4周时显著改善溃疡愈合。尽管如此,含银敷料还是被许多临床医生用于减轻严重的细菌表面污染[55]。
伤口敷料 — 当给伤口使用适合的敷料并且恰当更换时,敷料可以对伤口愈合的速度、皮肤修复后的伤口强度和功能以及所得疤痕的美观产生重要影响。没有单种敷料适用于所有伤口;临床医生应该对各个伤口进行评估并根据不同的伤口情况来个体化选择最适合的敷料。此外,必须不断监测伤口,因为它们的特点与敷料要求都会随时间而改变[56]。
对于如何选择不同类型的伤口敷料几乎没有临床证据可供参考。共识意见支持根据以下基本原则处理慢性伤口[57]:
在清创阶段使用水凝胶敷料
在肉芽形成阶段用泡沫和低附着性敷料
在上皮形成阶段用水胶体类和低附着性敷料。
总而言之,选择最合适的敷料保持伤口内及周围的湿润度。尽管一些敷料在局部抗菌作用、气味控制或轻度的清创能力上可能有额外的益处,但这些都是次要的[58]。
敷料通常一日或隔日更换一次,以避免扰乱伤口愈合环境。因为有些敷料可能阻碍伤口愈合的某些方面,这些敷料应慎用。比如,含大量钙的藻酸盐敷料可能通过引起角质形成细胞的过早终末分化而阻碍上皮形成[57],而银浸敷料有细胞毒性,无重大感染时不应使用。
伤口湿润的重要性 — 在医学史上很长一段时间内,曾认为伤口不应被封闭而应该暴露于空气中。然而,一项以猪为模型的重要研究表明,湿润的伤口愈合比干燥的伤口更快[59]。在人体也得到了类似的研究结果[60-62]。
密闭的伤口比不密闭的伤口愈合快,快的程度高达40%[60]。部分原因被认为表皮细胞在敷料创造的湿润环境中更容易迁移[61]。另一个促进伤口愈合的机制可能是伤口暴露在自己的渗液中[63]。急性伤口渗液富含金属蛋白酶、PDGF和碱性成纤维细胞生长因子(basic fibroblast growth factor, FGF),它们彼此间相互作用,并且与其他细胞因子相作用,从而刺激愈合[64]。而在另一方面,慢性伤口渗液对愈合可能并无好处。慢性伤口渗液与急性伤口渗液非常不同,前者含有的炎性细胞因子水平持续较高,而这可能抑制成纤维细胞的增殖[65-67]。伤口周围过度的水肿和硬结促进了慢性伤口渗液的形成,应对其进行处理将影响减到最小。
除加快伤口愈合外,使用密闭性敷料治疗的伤口与不太明显的疤痕形成相关[68]。一项以猪皮为模型的研究发现,与用干燥纱布相比,用密闭性敷料覆盖的伤口,愈合过程中的炎症期和增殖期加速[69]。整个伤口愈合阶段的“加速”可能阻止出现慢性伤口状态,而慢性伤口状态的通常会停滞在愈合的炎症阶段。有大量炎症的伤口更易导致更明显的疤痕,因此通过伤口闭合减少炎症和增生,可能也会减少疤痕的出现。
理想的敷料有以下特点:
能吸收过多的创面渗出液,同时也能保持湿润环境
能保护伤口免受进一步机械性或腐蚀性损伤
能预防细菌侵入或增殖
能与伤口形状贴合,消除死腔
能清除坏死组织
不会浸渍周围的活体组织
能通过压迫止血和最大程度减轻水肿
不会脱落能引起异物反应或超敏反应的纤维或者化合物
更换敷料期间和2次更换敷料间隔期内没有疼痛
最大程度减少更换敷料的次数
价廉、容易获取、保质期长
透明,不用打开敷料就能监测伤口外观
在大多数情况下,并没有一种敷料拥有所有这些特点,临床医生必须在特定的伤口情况下决定哪一点最为重要。对急性和慢性伤口都必须保持创面水分含量平衡。创面必须保持促进愈合的足够湿润,但是必须吸收伤口过多的渗出液以避免健康组织被浸渍。
普通敷料 — 尽管可以根据很多特性将敷料分类,但是通过敷料的保水能力来分类最为有用,因为敷料的首要目的是保持创面环境的湿润。据此,敷料被分为开放式、半开放式和半闭合式。
开放式敷料主要包括纱布,通常将纱布用生理盐水浸湿后再放置到伤口上。纱布绷带有各种尺寸,包括2x2英寸、4x4英寸的正方形敷料和3或4英寸的绷带卷(如Kerlix™)。更厚的吸收垫(例如ABD垫)被用来覆盖在纱布敷料之上。在处理较大伤口时,可用自粘性胶带(蒙哥马利粘带)将大块敷料固定在适当的位置。如上所述,不鼓励使用干燥纱布敷料。在可进行伤口闭合或者覆盖之前,润湿的纱布敷料有助于填补大量软组织缺损。纱布敷料价格便宜,但是常需要频繁的更换。
半开放式敷料主要包括浸石油、石蜡或者其他油膏的细孔纱布,商品名包括Xeroform™、Adaptic、Atrauman、Jelonet™和Sofra Tulle。第1层(上述浸有油膏的细纱布)上覆盖由吸水纱布和吸收垫组成的第2层,最后,第3层使用胶带或者其他方法粘合固定。半开放式敷料的优点是费用最低、易于使用。这种敷料的主要缺点是它不能维持湿润的伤口环境,也不能良好控制渗出液。半开放式敷料允许渗出液穿过第1层敷料并在第2层被吸收,既使得创面干燥,又浸渍了与第2层敷料接触的周围组织。半开放式敷料还有其他缺点,如敷料体积大、当运用于某些部位时不方便并且需要频繁更换。
半闭合式敷料有各种各样的闭合性、吸收能力、贴合性和抑菌活性。半闭合敷料包括薄膜类、泡沫类、藻酸盐类、凝胶类和水凝胶类,将分别在下文详细讨论。
薄膜敷料 — 高分子膜是合成的自粘敷料的透明片材,它允许气体(如水蒸气和氧气)通过,但是对大分子(包括蛋白质、细菌)不具有通透性。这种性能可使水分不显性丢失的蒸发,伤口渗液含的酶类留在敷料内并阻止细菌侵袭。这类敷料有时被称为合成的有粘附性的可透水蒸气的湿润敷料,包括Tegaderm™、Hydrofilm、Cutifilm®、Blisterfilm™和Bioclusive。一篇对33项已发布研究的综述发现,透明薄膜敷料用于覆盖分层移植皮片供皮区能带来最快的愈合速度、最低的感染率,而且是最有经济有效的方法[70]。
这类敷料的优点包括保持湿润、促进快速的上皮再形成的能力以及它们的透明外观及自粘的特性。薄膜敷料的缺点包括有限的吸收能力,不适合中至重度渗出的伤口。如果将它们用于覆盖重度渗出的伤口,周围的皮肤很可能会被浸软。此外,如果创面变干燥,薄膜敷料可能粘附在伤口上,在移除敷料的时候会很疼,并且会损伤创面。
泡沫敷料 — 泡沫敷料可以被认为是吸收能力增加的薄膜敷料。这类敷料包括2层,一层以亲水的硅树脂或者聚氨酯为基础的泡沫直接接触创面,一层疏水透气的背衬防止渗液漏出和细菌污染。有些泡沫敷料需要附加一层粘附敷料。泡沫敷料的商品名包括Permafoam、Allevyn™、Adhesive、Lyofoam和Spyrosorb。
泡沫敷料的优点包括强吸收力、它们能贴合伤口的形状以及能用于填充创腔。缺点包括是敷料不透明以及这类敷料需要每日更换。由于泡沫敷料可能会导致创面干燥,可能不适用于轻度渗出的伤口。
一项小型试验对机构内收容的成人的皮肤撕裂伤口比较了泡沫敷料和薄膜敷料,发现泡沫敷料组的完全愈合率更高[71]。
海藻酸盐敷料 — 从各种藻类中获得的天然复合多糖是海藻酸盐敷料的主要成分。它们作为敷料的作用是独一无二的,因为它们不溶于水,但是在富含钠离子的伤口渗液环境中,这些复合物能以钙离子交换钠离子,形成一层无定形的凝胶填充并覆盖伤口。海藻酸盐敷料可以被制成各种形状,如带状、球状、块状。它们的吸收能力范围取决于使用的多糖种类。总而言之,这类敷料更适用于中至重度渗出的伤口。
海藻酸盐敷料的优点包括增加的止血作用[72,73],它能用于伤口填充,大多数能用生理盐水冲洗掉,从而能最大程度地减少更换时的疼痛,而且这种敷料好几天才需要更换一次。海藻酸盐的缺点在于它们还需要额外附加一层敷料,但这层敷料在监测伤口情况时必须被除去,而且它们用于轻度渗出的伤口时可能会太干燥,且其气味难闻。
在一项纳入77例患者的试验中,糖尿病足创伤患者被随机分为使用海藻酸盐敷料组与使用油纱敷料组[74]。治疗4周时,与油纱敷料组相比,海藻酸盐敷料组有显著更好的肉芽组织覆盖,疼痛明显更少,敷料更换也更少。
水胶体敷料 — 水胶体敷料通常由在自粘性的聚氨酯薄膜载体上含有凝胶或泡沫构成。这种敷料的胶质成分吸收渗出物,并且能创造一个湿润的环境。细菌和组织碎片也能被吸收,并在换药时以轻柔、无痛的机械清创术形式冲洗干净。水胶体敷料的另一个优点是可以填充伤口。它的缺点包括恶臭和可能需要每日更换,而且已经有这类敷料引起变应性接触性皮炎的报道[75]。水胶体敷料产品包括Hydrocoll、DuoDERM®、Tegasorb™、J & J Ulcer Dressing和Comfeel®。
卡地姆碘是一种含碘的水胶体,接触伤口渗液后,碘分散并被缓慢地释放。释放的碘浓度很低,不会造成组织损伤[76]。一项多中心的试验发现,对于渗出性静脉溃疡患者,使用卡地姆碘软膏治疗12周,比不含碘的水胶体敷料或油纱敷料更经济有效[77]。一篇系统评价发现一些证据,与标准治疗(伴或不伴压迫)相比,局部用卡地姆碘提高了静脉溃疡的愈合率[25]。所用治疗方案复杂,且尚不明确结果能否外推至大多数临床情况。有使用卡地姆碘治疗腿部溃疡时出现了碘诱导的甲状腺功能亢进的记录[78]。
水凝胶敷料 — 水凝胶敷料是一种由各种含水量超过95%的合成聚合物基质组成的片、凝胶或者泡沫,通常夹在两层可去除的薄膜中间。内层直接覆盖在伤口上,外层能被除去,从而使敷料对渗液可渗透。有时还需要附加一层粘附敷料。这种独特的基质能根据周围组织的水合作用状态吸收或者析出水分。水凝胶产品包括Intrasite Gel™、Vigilon®、Hydrosorb Gel、Carrington Gel和Elastogel。
水凝胶敷料对干燥伤口最有用。它们先降低所覆盖伤口的环境温度,对于一些患者能起到冷敷缓解疼痛的作用[79]。但缺点是发现水凝胶敷料会能选择性地允许革兰氏阴性菌增殖,尽管尚无报道证实水凝胶敷料增加了伤口感染[80]。
水活性敷料 — 水活性敷料是最新开发的合成敷料,是一种综合了凝胶和泡沫特性的聚氨酯基质。它选择性吸收过多的水,同时留下生长因子和其他蛋白质[81]。
一项将水活性敷料与2种不同的水胶体敷料进行比较的随机试验发现,经过12周的治疗,水活性敷料在提高溃疡愈合和减轻溃疡相关性疼痛方面同样有效[82]。另一项研究发现,在治疗压力性溃疡和静脉淤滞性溃疡时,水活性敷料联合酶法清创术比单用纱布更经济有效[83]。
伤口填充 — 有大量软组织缺损的伤口在未损伤的表面健康皮肤和伤口基底部之间可能有一大块死腔。这类伤口被描述为窦道或者潜行。潜行伤口被定义为是指伤口在未受损的皮肤边缘下面延伸扩展,以至于测量的伤口基底比从皮肤表面估计的更大。
在描述和记录潜行伤口时,准确测量潜行伤口的深度(cm)并用钟表指针方向定位潜行伤口(12:00、6:00等),这一点比较重要。坏死组织的存在表明需要手术清创以减少细菌负荷并防止感染后遗症[21]。
尽管尚无比较填充与不填充伤口的特异性试验,但伤口填充被认为是标准治疗方法[84]。传统的纱布敷料经常被用来填充有很大死腔或潜行伤口,以帮助继续将失活组织从创面上清理下来。纱布用生理盐水或自来水湿润后置于伤口内,再覆盖多层干纱布。随着湿润的纱布变干,会粘附在表面组织上,更换敷料时表面组织也就会被一同除去。应频繁更换敷料以保证纱布不会完全干透,可一日2-3次。纱布敷料的缺点是移除敷料时可能会同时移除正在生长的肉芽组织,造成再次损伤。所以,当坏死组织已经去除、肉芽组织出现时,停用这种敷料。治疗具有很大死腔的伤口时,可用负压伤口疗法替代纱布敷料。
许多被用作伤口局部敷料的材料(泡沫、海藻酸盐、水凝胶)可以被做成伤口的形状,这有助于伤口填充。与这些材料应用于覆盖伤口时一样,对于哪种材料对伤口填充最有益并未达成共识。大量组织缺损的伤口更换敷料时可以使用蒙哥马利贴带,而不用反复在皮肤上贴胶。
伤口闭合 — 一期闭合是指适当的伤口预处理后,对急性手术切口或者外伤伤口通过缝合或者钉合以关闭伤口(图 1和图 2)。
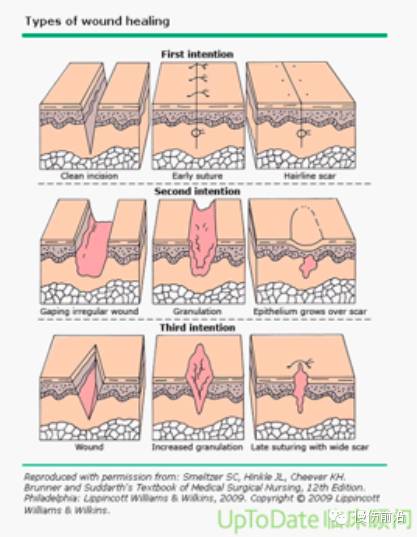
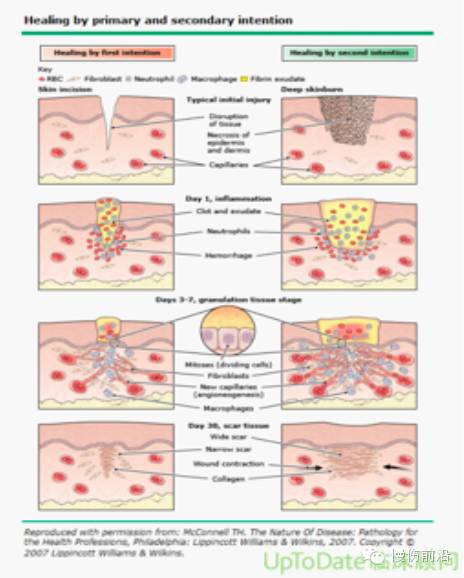
延迟的一期闭合是在一段时间的伤口处理后实现皮肤边缘对齐。没有感染证据的腹部伤口、胸部伤口以及手术切口的延迟闭合被广泛接受(图 1)[85]。但慢性伤口绝不应一期闭合,相反,可以实施延迟闭合或覆盖。
负压伤口疗法 — 负压伤口疗法能促进伤口愈合,其机制是通过减少伤口周围组织水肿、刺激循环以及提高肉芽组织形成率[86-89]。这项技术是在覆盖了泡沫敷料的伤口上施以受控的低于大气压的压力。负压伤口疗法有利于治疗大面积缺损,直至可进行闭合。在压力性溃疡[90-92]与糖尿病性伤口[89,93]的治疗中,这种疗法也取得了较小程度的成功。
伤口覆盖
皮肤移植 — 断层皮片移植和全层皮片移植是最基础的生物敷料,是从供体部位取得并移植于同一患者的伤口部位的皮肤。皮肤移植被应用于伤口闭合,以预防液体和电解质丢失、减少细菌负荷及感染。同一个体不同部位间的皮肤移植被称为自体移植。
根据移植皮中的真皮厚度,皮肤移植被分为断层皮片移植或全层皮片移植。部分或断层皮片移植使用不同厚度的真皮,而全层移植皮片含有全部真皮。真皮部分较厚的移植皮可维持正常皮肤的特点。但因为需要血管再生的组织量更多,较厚的移植皮需要更健康的创面。选择全层皮片移植还是断层皮片移植取决于伤口的状况、部位、大小和美容需求[94]。
全层皮片移植 — 全层皮片移植包含表皮和真皮,所以与断层皮片移植相比,前者保持更多正常皮肤的特点,包括颜色、质地和厚度。全层皮片移植仅限用于相对较小的、未受污染且血供良好的伤口。全层皮片移植使用的皮肤是从量多且质柔的皮肤区域取得,诸如腹股沟、股外侧、下腹部或胸部外侧。供体部位通常进行一期闭合。全层皮片移植的主要缺点包括供体皮肤的供给有限,并且移植皮肤下方可能产生积液。
断层皮片移植 — 断层皮片移植常用于伤口覆盖。断层皮片移植包括表皮和不同厚度(厚度在0.008-0.012英寸之间)的真皮(图片 3)。根据移植切割的皮片厚度,断层皮片移植又进一步分为薄皮片(0.005-0.012英寸)、中皮片(0.012-0.018英寸)、厚皮片(0.018-0.030英寸)。

与全层皮片移植相比,断层皮片移植可以用于不太理想的创面,有更广泛的应用范围。它可以用于修复大型伤口、线性腔、修复黏膜缺损、关闭供体部位皮瓣和修复肌瓣。对于病灶去除后产生的伤口,其在根治性重建前需要病理学检查,也可使用断层皮片移植进行暂时闭合。
断层皮片移植可以通过制成网状来覆盖更大面积的受区,扩展比通常在1:1-6:1之间。断层皮片移植供区通过剩余表皮附件提供的细胞自行愈合。一旦完全愈合,供区又能再次取皮。
断层皮片移植有需要考虑的缺点。断层皮片移植更脆弱,尤其是覆盖部位附带的有支持作用的下层软组织量很少时。它们在愈合的时候收缩得更多,不随着个体而生长,而且由于移植中皮肤附件的缺失,它们会比正常皮肤更平滑、更有光泽。它们还倾向于出现不正常的色素沉着(苍白或白色、或者两者交替),或者色素沉着过度(特别是深色皮肤的个体)。因为这些原因,分层皮片移植更广泛应用于控制感染、预防液体或电解质丢失,而非美容术[94]。
皮肤替代物 — 人类皮肤替代物是由两层存活的皮肤结构组成的生物敷料,包括外层活的同种异体的人类角化细胞,另一层是分布于真皮层基质中的Ⅰ型胶原上活的同种异体成纤维细胞。两层细胞都由人类婴儿包皮生长而来。人类皮肤替代物看上去摸上去就像人类皮肤,且能有效刺激伤口愈合。
当传统敷料失败或者被认为不合适的时候,可以使用皮肤替代物。一项研究表明,当慢性伤口的愈合未达到适当的闭合率(即在4周治疗内伤口区域减小55%)时,应该使用高级生物制品[95]。人类皮肤替代物是慢性溃疡理想的治疗方法,因为在不充分的伤口愈合环境中加入了更多细胞和生长因子。加速伤口愈合可以减少伤口感染的风险。
基于起源的皮肤层,这些敷料被分为以下几类:
真皮皮肤替代物由真皮成分(如胶原、成纤维细胞)组成,能防止伤口收缩,提供更高的稳定性[96]。真皮皮肤替代物包括:AlloDerm®,由去细胞化的同种异体真皮成分组成;Integra™,一种基于牛胶原的真皮基质;Dermagraft-TC™,是嵌入人类成纤维细胞的尼龙网。每一种都已经成功用于烧伤伤口的治疗[97-99]。
复合皮肤替代物使用表皮和真皮成分。Apligraf®包括牛胶原和同种异体成纤维细胞、表皮细胞。与单独运用加压疗法相比,Apligraf®联合加压疗法使用能改善静脉淤滞性溃疡的愈合[100]。尚无临床排异反应的报道。
人类皮肤替代物也已在糖尿病患者中进行了研究[101-104]。在一项纳入208例非感染的神经性溃疡患者的研究中,与普通治疗相比,使用Graftskin一周1次,持续4周后,伤口完全愈合率有所改善(56% vs 38%)[101]。
辅助治疗
高压氧疗法 — 体外试验已证实高压氧疗法对伤口愈合有作用[105]。由于内皮祖细胞参与缺氧区新生血管形成,在伤口愈合中起着重要的作用[106]。尽管高压氧带来的组织内高氧有效促进了内皮祖细胞的动员,但治疗并非以伤口部位为靶点。严重不良事件(包括癫痫发作和气胸)可能与高压氧疗法有关。
当需要时,高压氧治疗在一个可监护舱内的患者的特制舱内完成。高压氧仓利用压缩氧气或空气将舱内压通常维持在2.5-3个大气压。不愈合的伤口治疗方法通常是一日1.5-2小时,持续20-40日[105]。高压氧治疗的机制和技术将在别处详细讨论。
高压氧已经被用于作为急、慢性伤口的辅助治疗[107-112]。大多数研究是观察性的,且现有的少量试验受限于样本量小和质量低[113-115]。一篇系统评价得出结论,尽管高压氧可能有益于某些类型的伤口(如糖尿病性溃疡),但无足够的证据支持其常规使用[116]。
急性损伤–高压氧治疗可能对广泛软组织损伤的患者有价值。一篇系统评价鉴定出3项评估高压氧治疗急性手术伤口和外伤性伤口的试验[117]。因为纳入的患者人数少以及所治疗患者的异质性,不能进行meta分析。作者们也指出偏倚的潜在风险。在其中一项试验中,36例挤压伤患者被随机分为2组,术后一组接受高压氧治疗,一次90分钟,一日2次,持续6日;另一组在术后接受总共6日的假性治疗[118]。高压氧治疗组完全愈合的患者明显更多(17例 vs 10例),且需要皮瓣、移植、血管手术或者截肢的患者更少(1例 vs 6例)。
筋膜切开术伤口–急性肢端骨筋膜室综合征切开术后的再灌注动物模型提示高压氧疗法可能有益。
热损伤–一项关于高压氧疗法治疗烧伤的系统评价只发现2项高质量的试验,得出结论为尚无足够证据支持热损伤后应用高压氧[119]。烧伤伤口的治疗将在别处详细讨论。
慢性溃疡–高压氧疗法已经被用作由静脉功能不全、糖尿病及外周动脉疾病所引起的慢性不愈合伤口和溃疡的辅助治疗。还缺乏证据支持应用高压氧疗法治疗静脉性溃疡、压力性溃疡以及与慢性缺血(外周动脉性疾病)有关的伤口。尽管高压氧疗法与糖尿病患者的溃疡加速愈合相关,但高压氧用于治疗不愈合的糖尿病足部溃疡的适应证仍不确定。
缺血性移植皮肤和皮瓣–高压氧治疗可能会提高血供受损的皮肤移植和重建皮瓣的存活率,从而防止组织分解和伤口发展。局部血管受损、之前接受过放疗的区域或者之前移植失败的位置需要皮肤移植或重建皮瓣的患者可能会从预防性治疗中受益。
其他治疗 — 各种其他治疗,诸如低频超声[120,121]、电刺激[122-125]、电磁治疗[126]和光照疗法[127],已主要被研究用于压力性溃疡或慢性静脉性伤口的治疗[128-132]。
特定伤口的处理
单纯撕裂伤–单纯外伤性撕裂伤可以清洁后,通过订合或缝合一期闭合。
复杂撕裂伤–清洁伤口和清创后,通常尝试闭合更复杂的撕裂伤。不规则皮缘或撕裂部位的伤口皮肤合拢后裂开的情况并不少见。可能需要整形外科技术以提供可接受的美容效果和功能结果。
大量组织缺损–外伤性伤口或因感染而清除失活的组织(例如Fournier坏疽)都可能引起大量组织缺损。清创完成后,伤口可以用润至湿的生理盐水纱布敷料开放式填充或使用负压伤口疗法,直至创面可以进行皮肤移植或皮瓣关闭[89]。
烧伤–烧伤伤口的治疗取决于多种因素,包括烧伤深度和解剖学部位。
压力性溃疡–压力性溃疡的治疗取决于溃疡分期。
糖尿病足部溃疡–糖尿病足部溃疡的处理根据溃疡的分级而有不同。
静脉性溃疡–静脉性溃疡治疗主要依靠压迫。
缺血性溃疡形成与坏疽–缺血的出现影响清创的时机和根治性的干预措施。面对湿性坏疽或脓肿时,无论伤口是否需要血运重建,都应立即清创。敷料的选择取决于预期引流的水平和伤口的大小。死腔通常用纱布填塞。如果需要血运重建,之后应立即进行腿部的血运重建。
但是,如果出现干性坏疽但不伴蜂窝织炎,应首先恢复肢体的血运。敷料的主要目标是保护伤口,从而降低感染或创伤的风险。为了完成这一目标,用大量干纱布绷带包裹伤口,包裹时轻柔以免加重缺血。血运重建后,应该密切监测伤口愈合或需要清创的不稳定征象。
总结与推荐
创面需要良好的血供、清除失活的组织、清除感染并且保持湿润以达到最佳的伤口愈合。
伤口敷料的选择主要基于它们:填塞死腔、控制渗出、更换时(如果适用)减少疼痛、防止细菌过度生长、保证适当液体平衡的能力、经济有效以及易于患者或护理人员操作。
我们建议,对于与急、慢性伤口或者溃疡相关的失活组织,应该使用锐性手术进行初步清创,而不用非手术清创(Grade 2C)。
局部用药(如消毒剂和抗菌剂)可用于控制局部严重污染。并未发现伤口愈合率有显著提高,组织毒性可能是一个重要的缺点。
对于深伤口,负压伤口疗法可以保护伤口、减少缺损的复杂性和深度。负压伤口疗法常用做复杂性伤口根治性闭合之前的治疗。
创面准备后,急性伤口通常可一期闭合。已证明逐步愈合(由伤口边缘出现肉芽组织和上皮形成证明)的慢性伤口可以进行延迟闭合或者通过皮肤移植或生物工程改造的组织实施覆盖。
许多其他治疗方法已被用来促进伤口愈合,包括高压氧疗法和使用超声波、电能和电磁能刺激伤口。其中有些治疗在随机试验中表现出些许效益,作为辅助疗法可能对于伤口愈合有帮助。



