
伤口世界

- 星期五, 21 11月 2025
Research progress on peptides that inhibit melanin synthesis

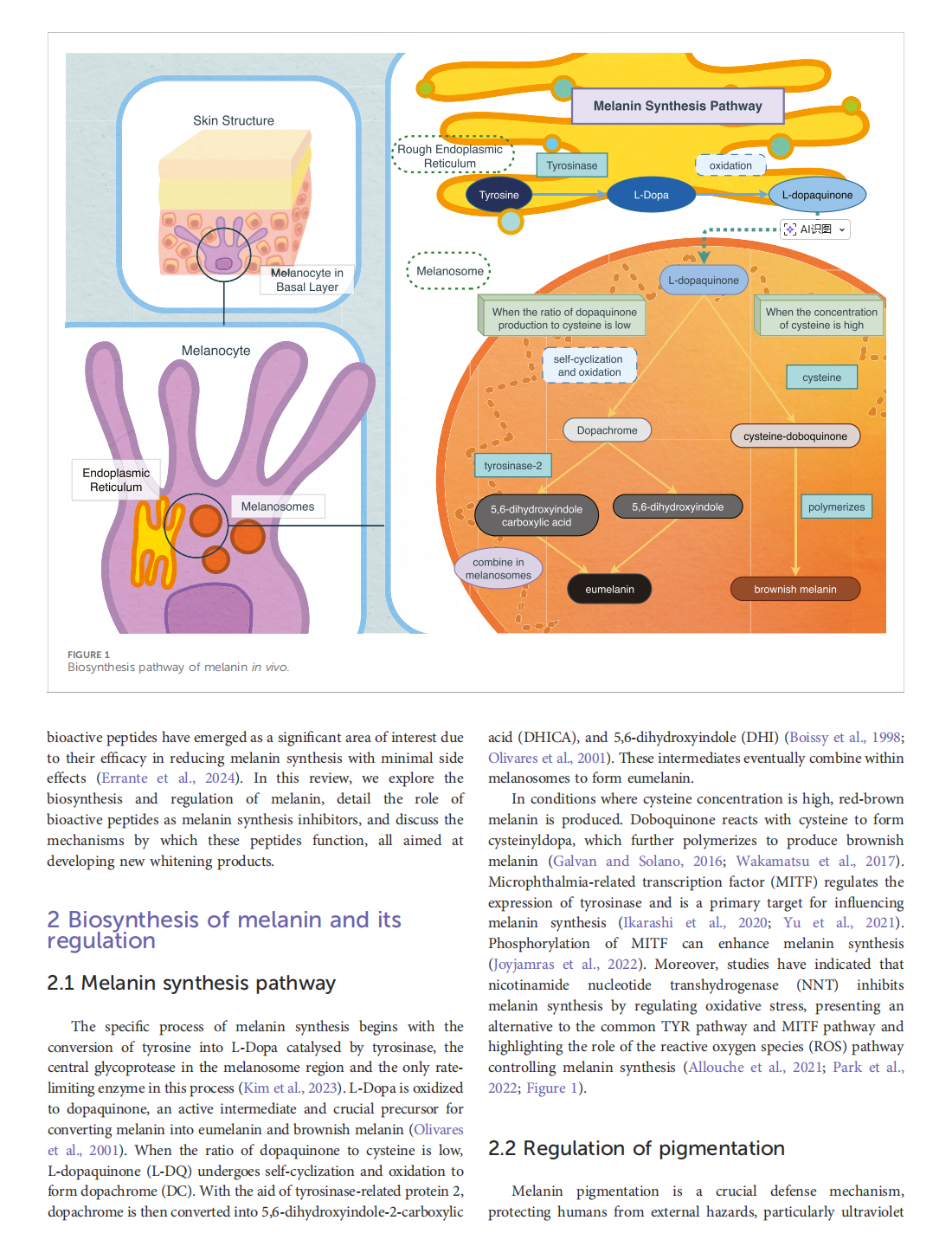



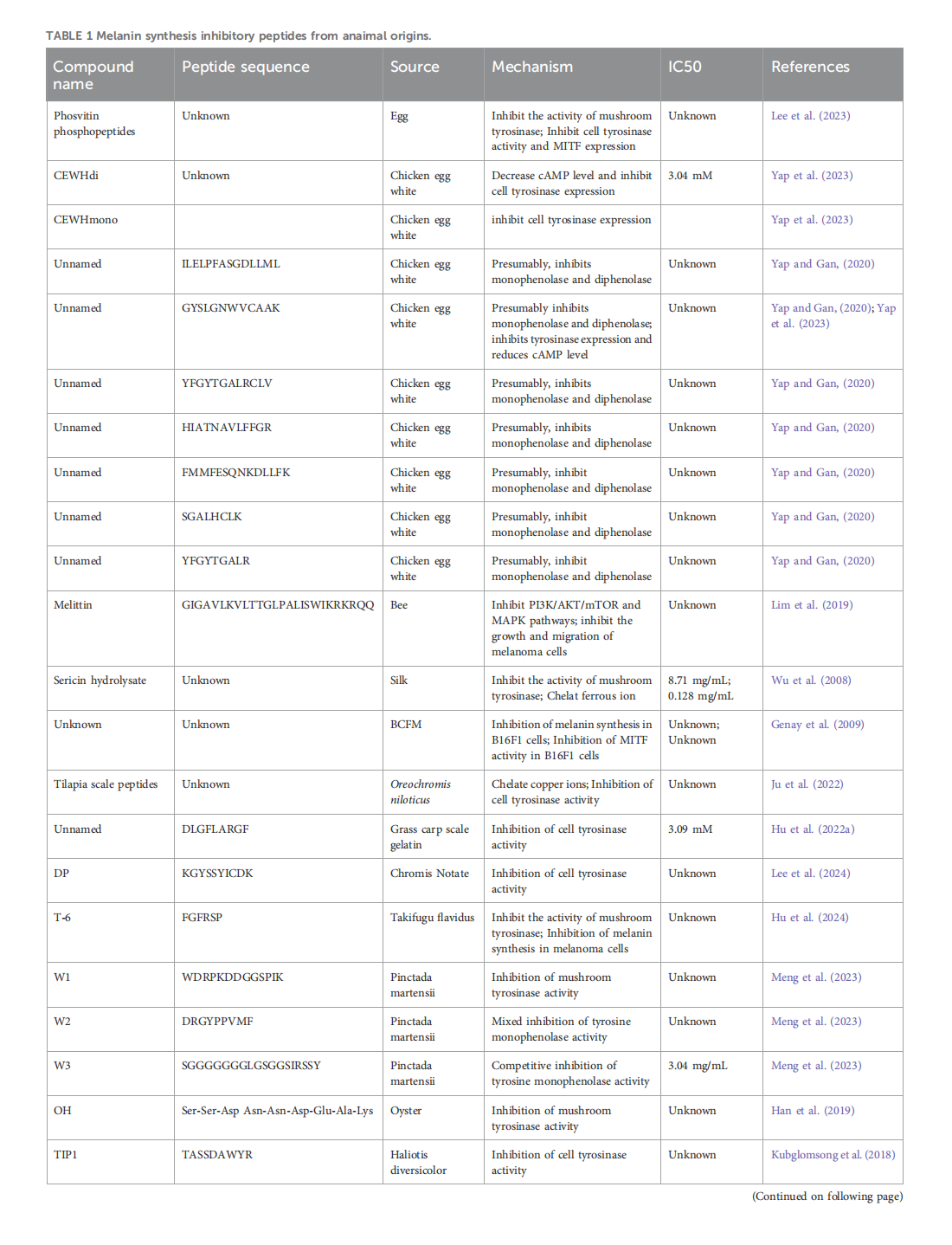
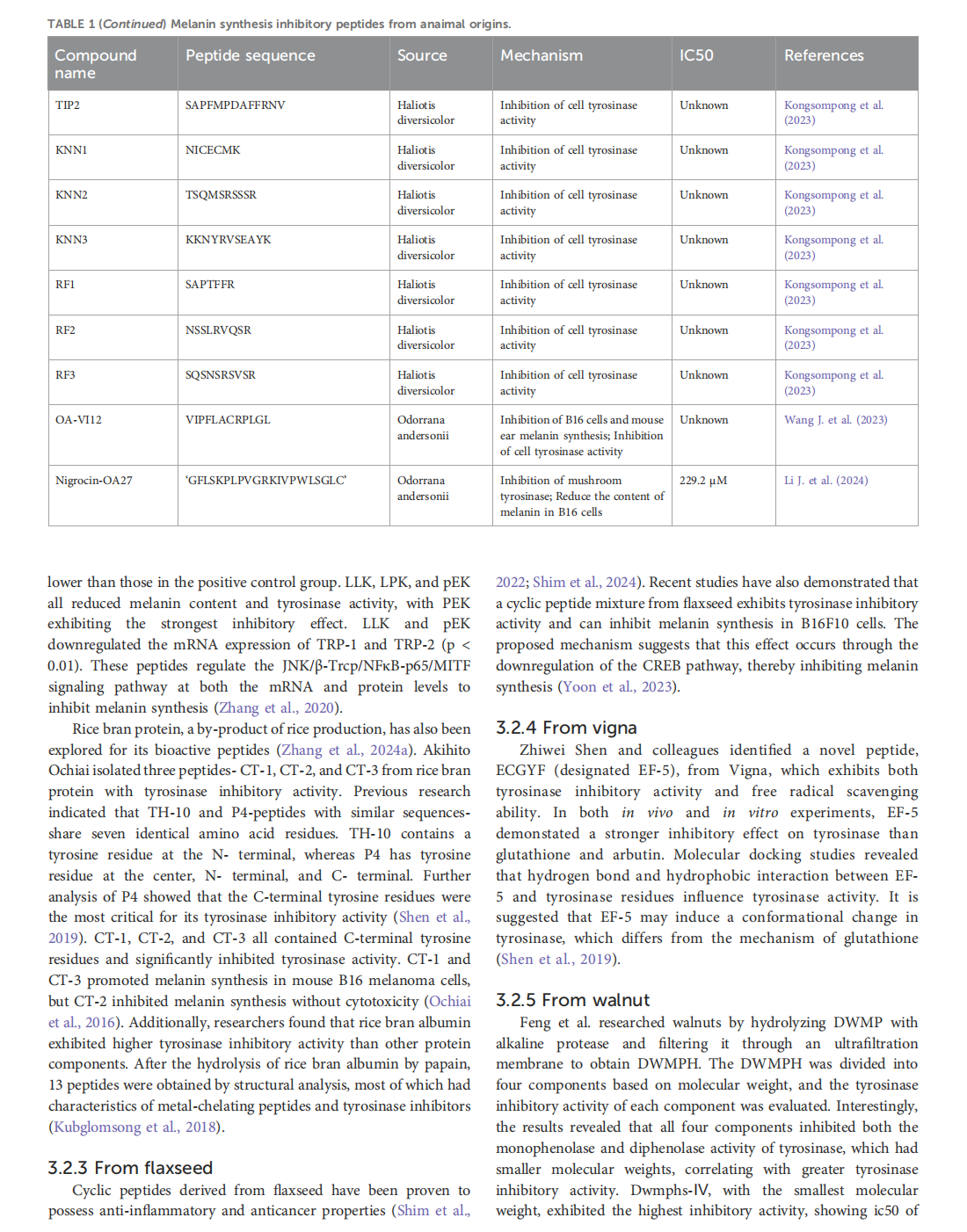
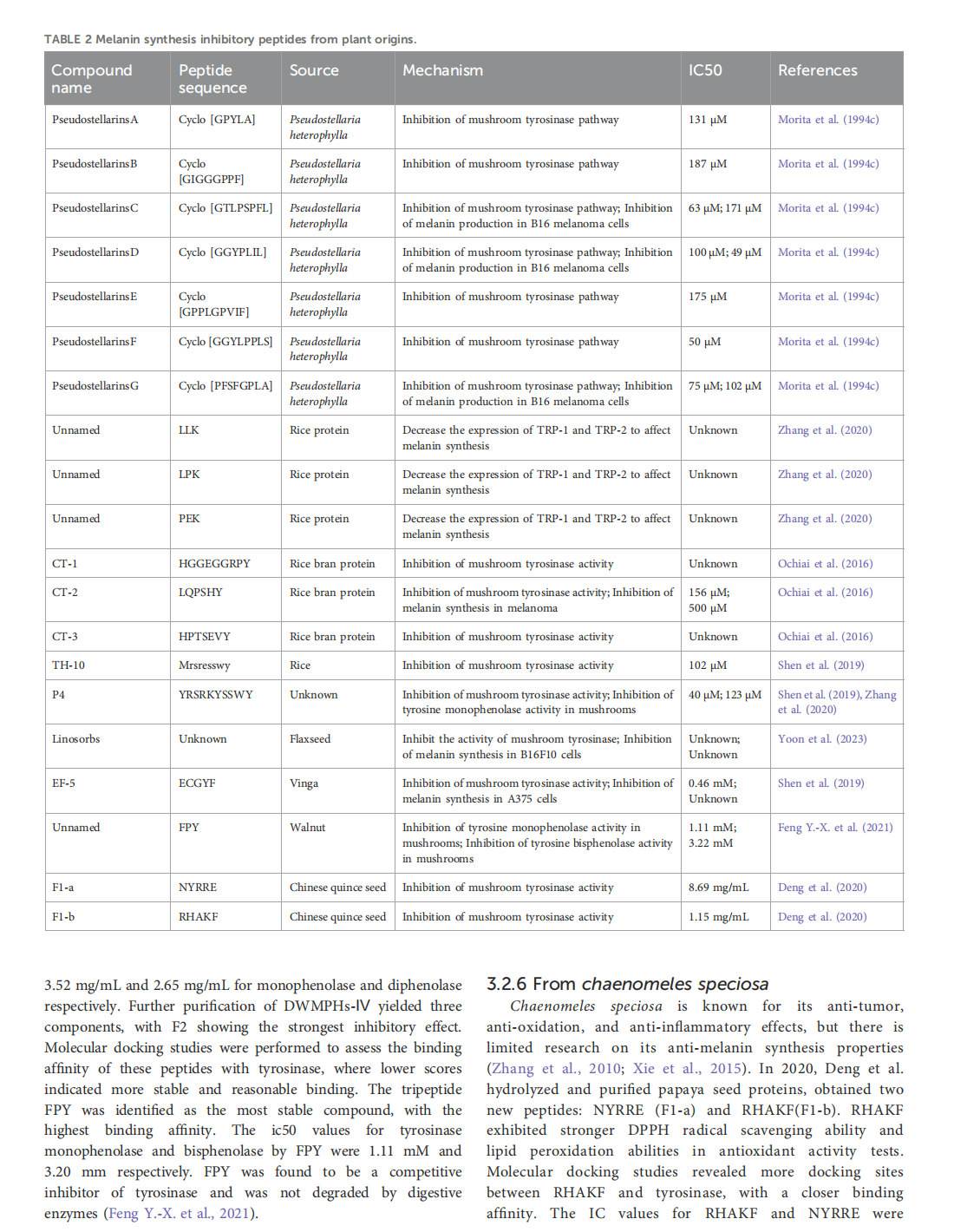
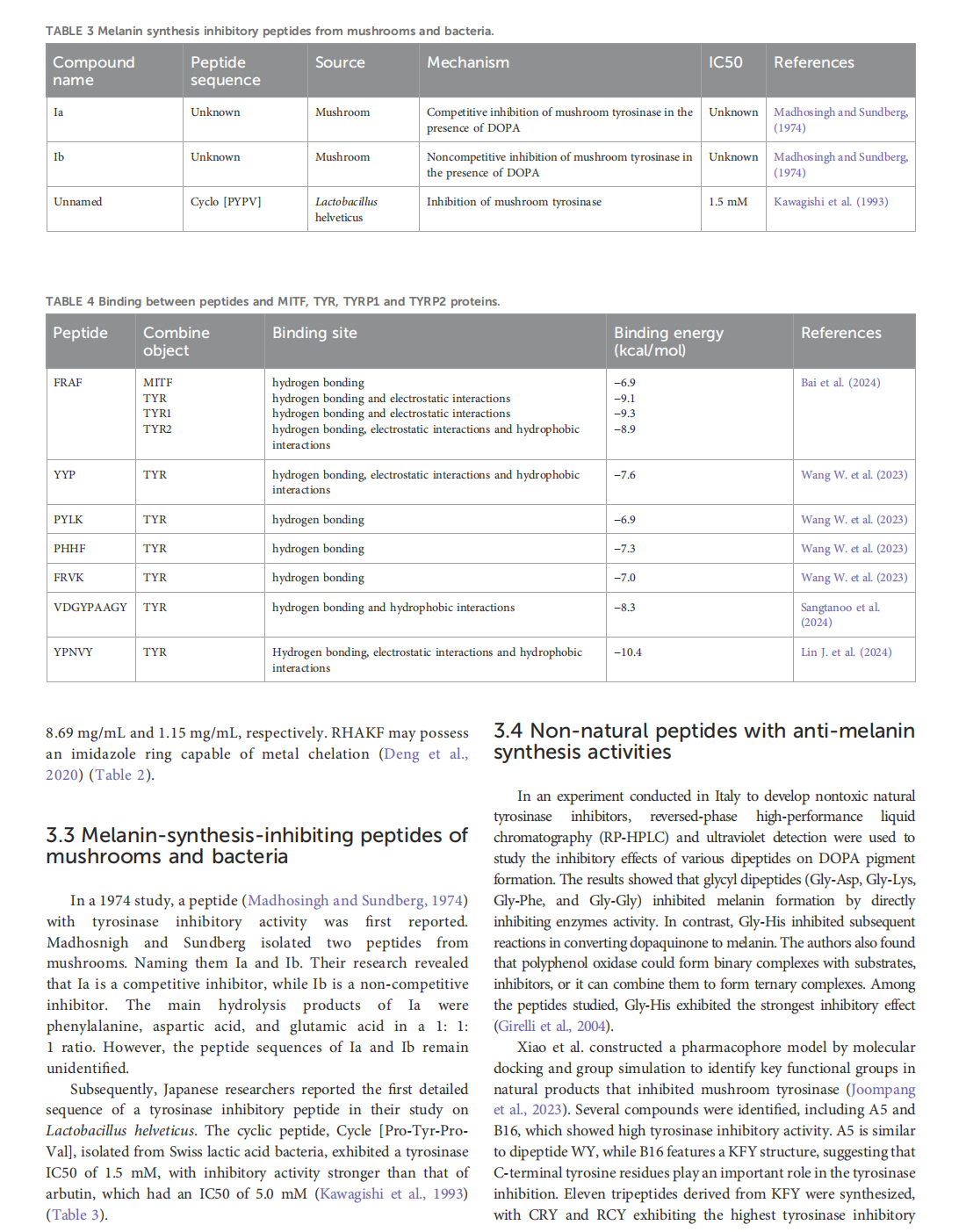



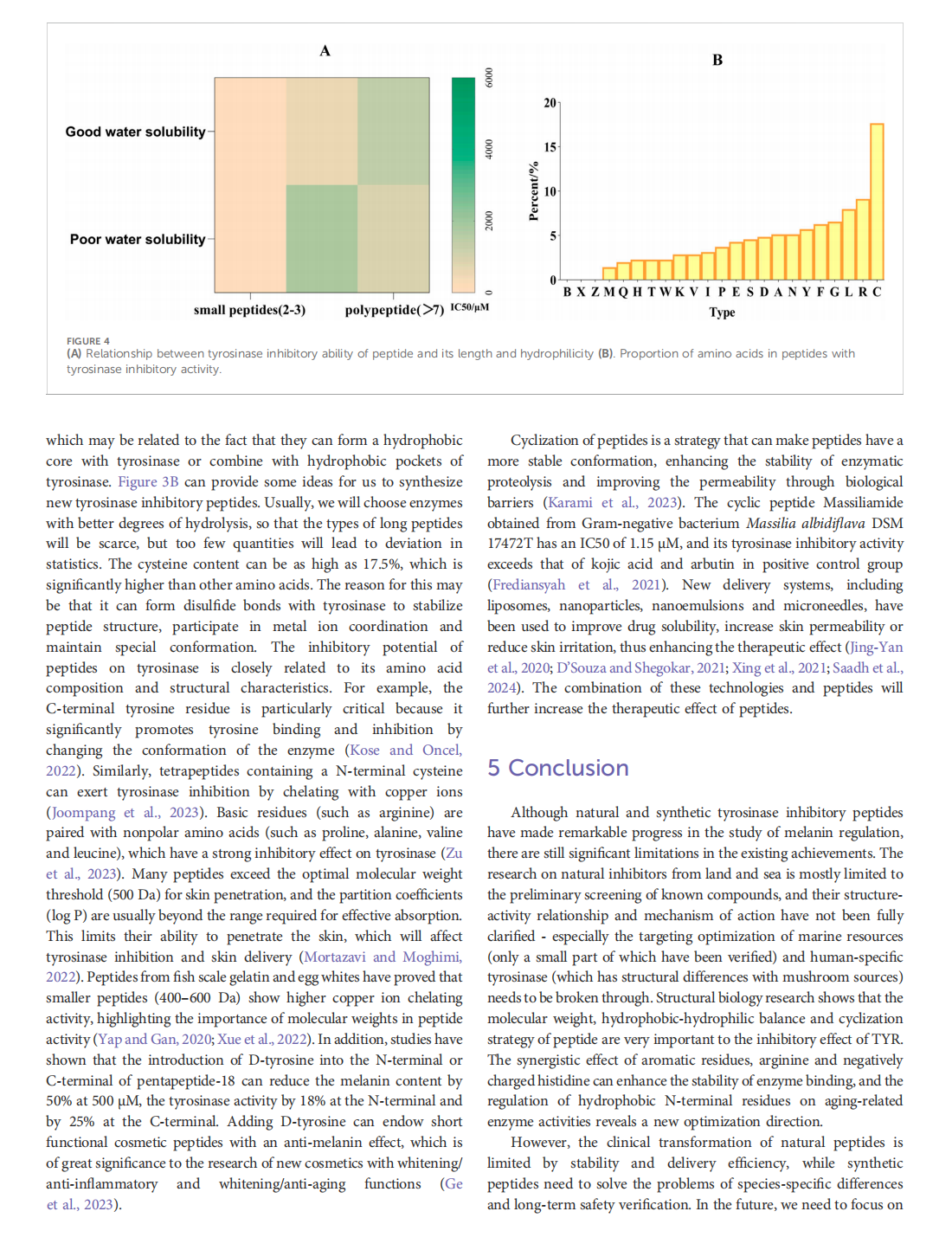





This article is excerpted from the《Frontiers in Pharmacology》 by Wound World

- 星期四, 20 11月 2025
Beneficial effects of proanthocyanidins on skin aging: a review



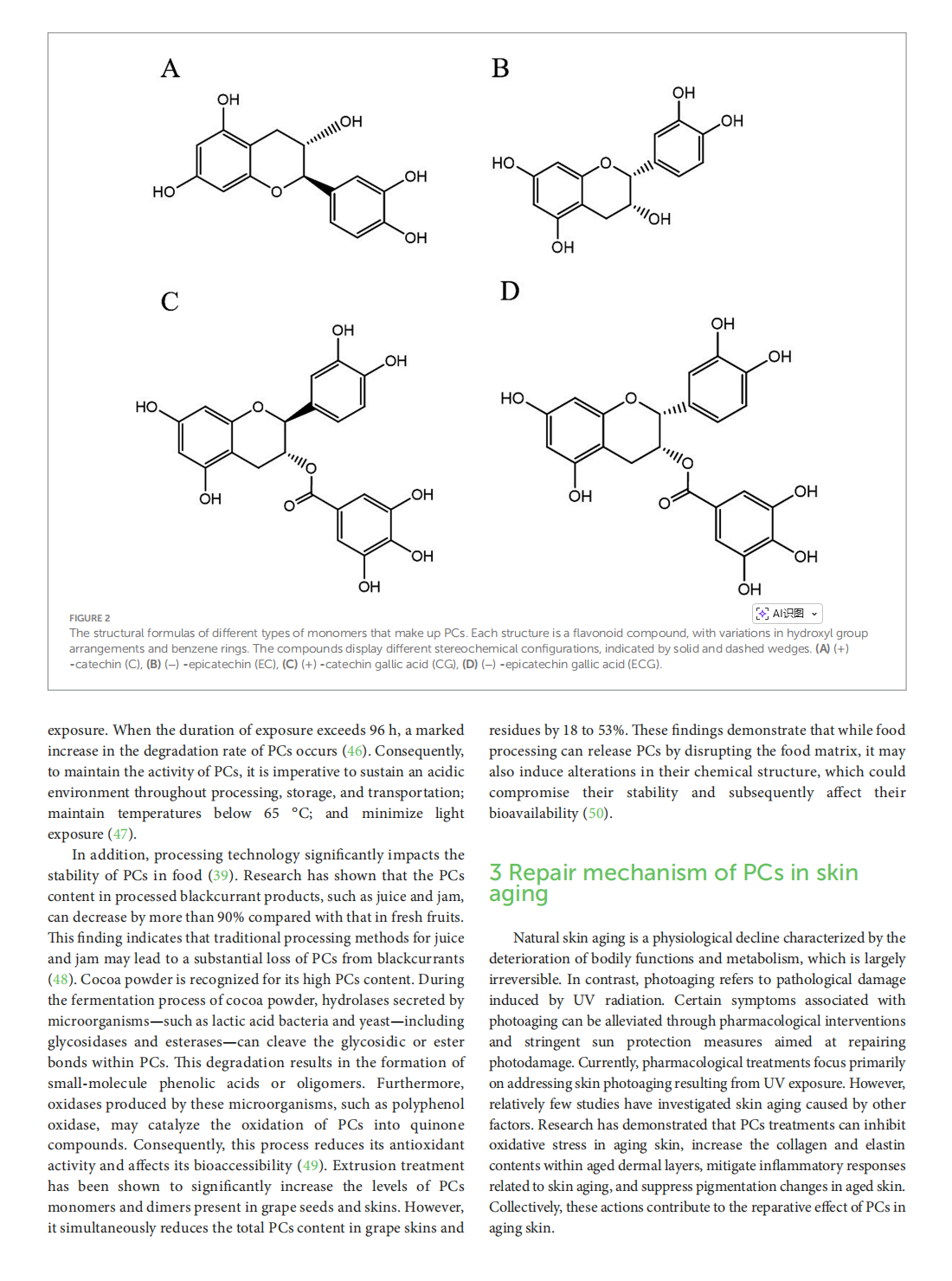
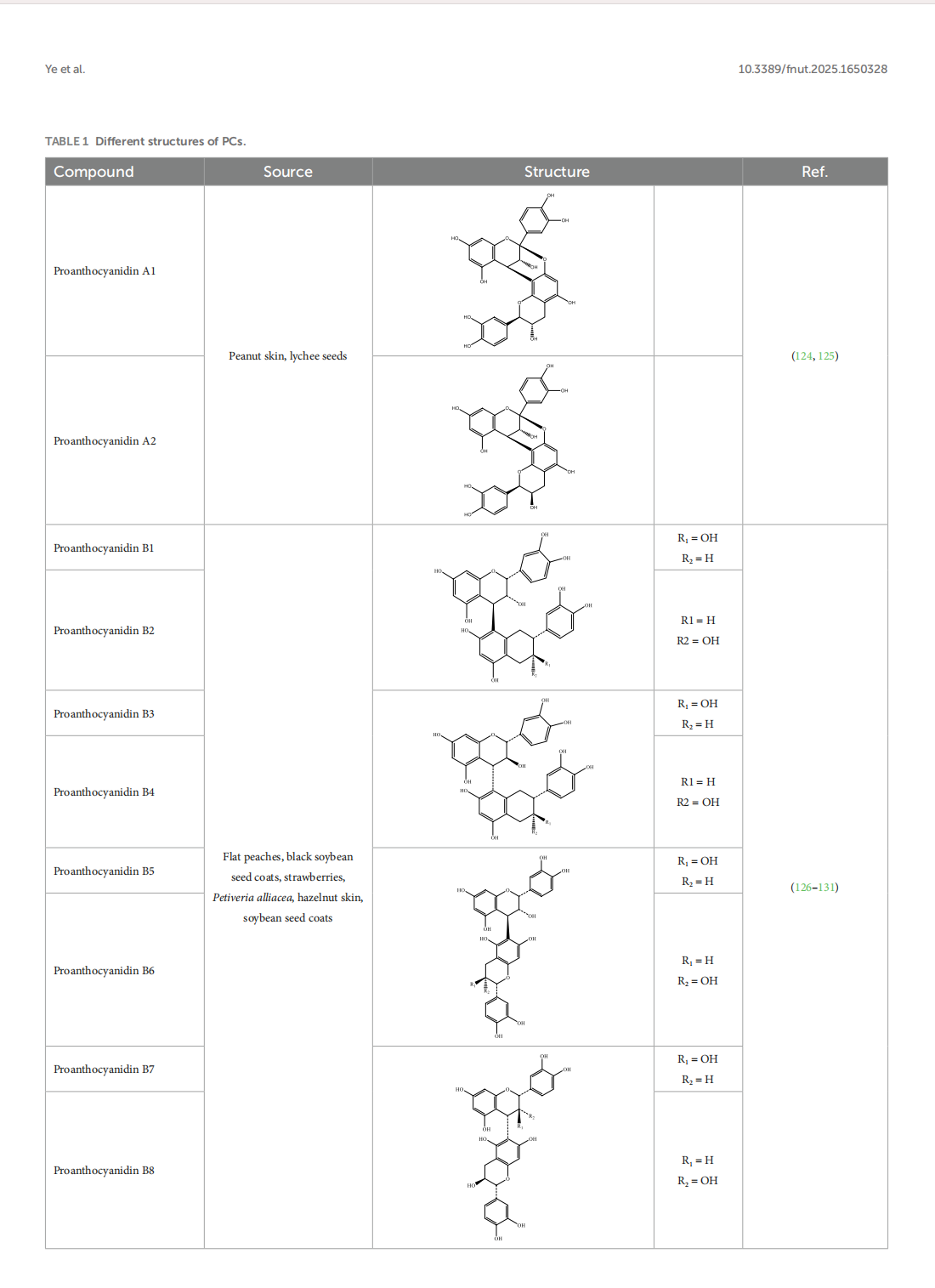

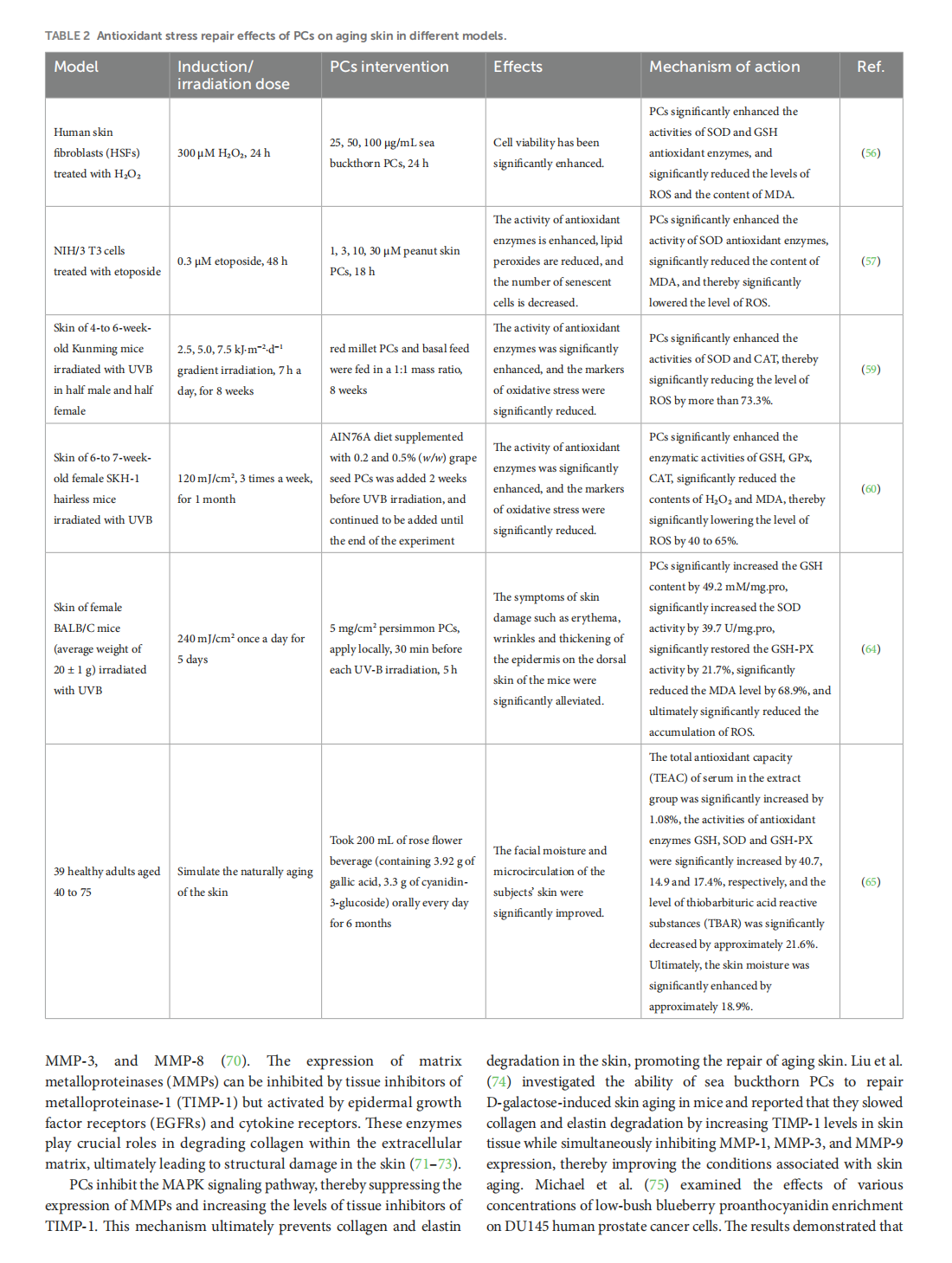

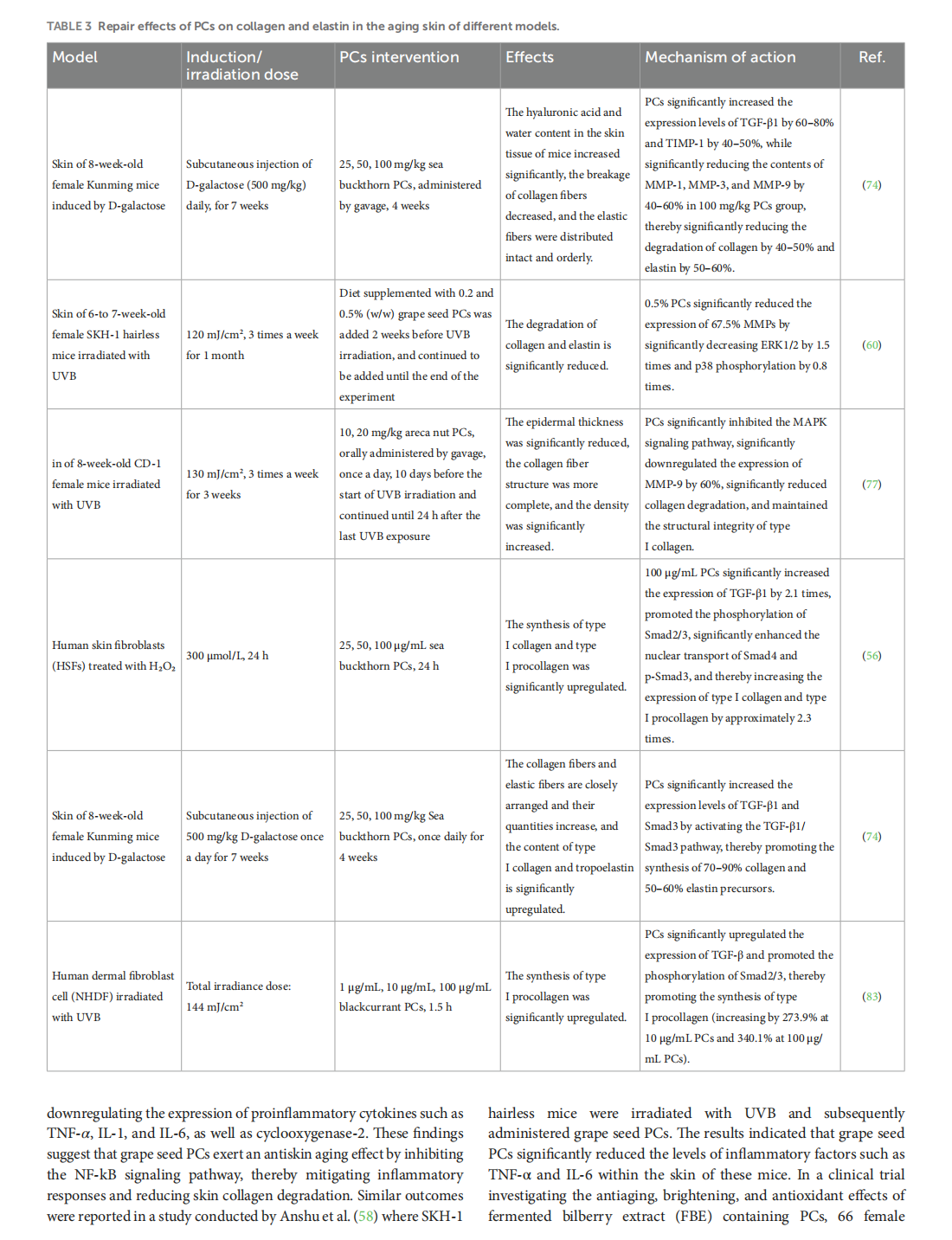
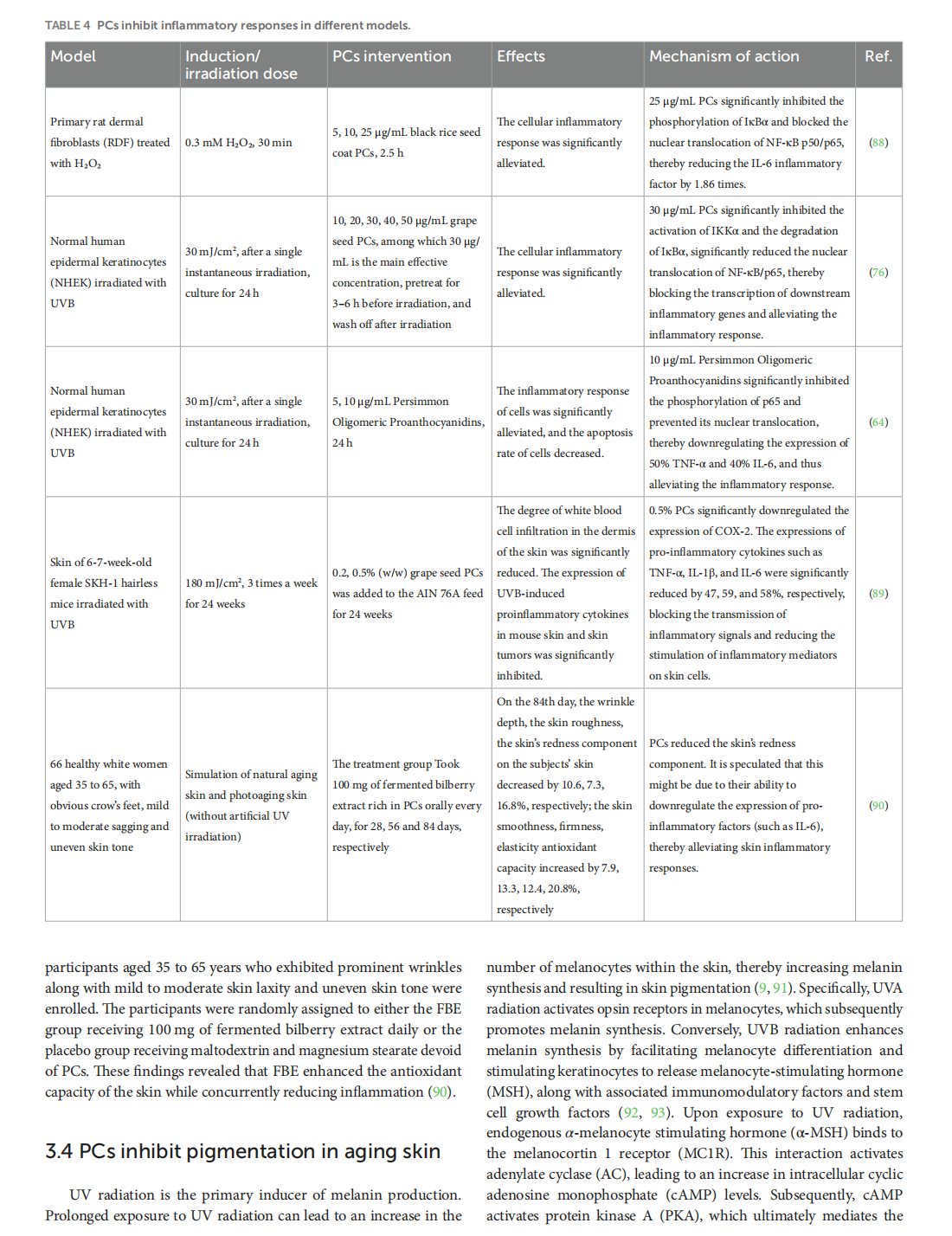

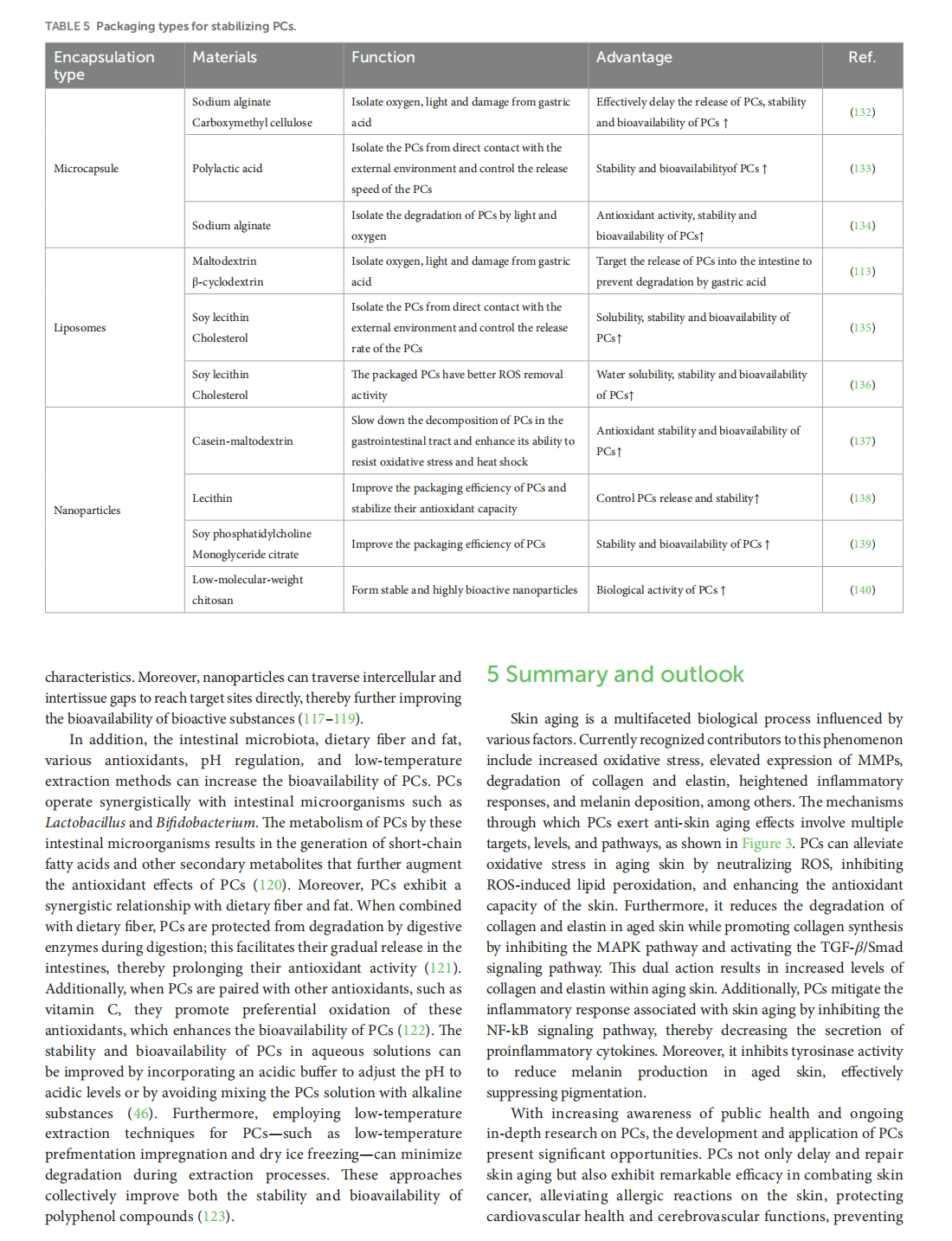
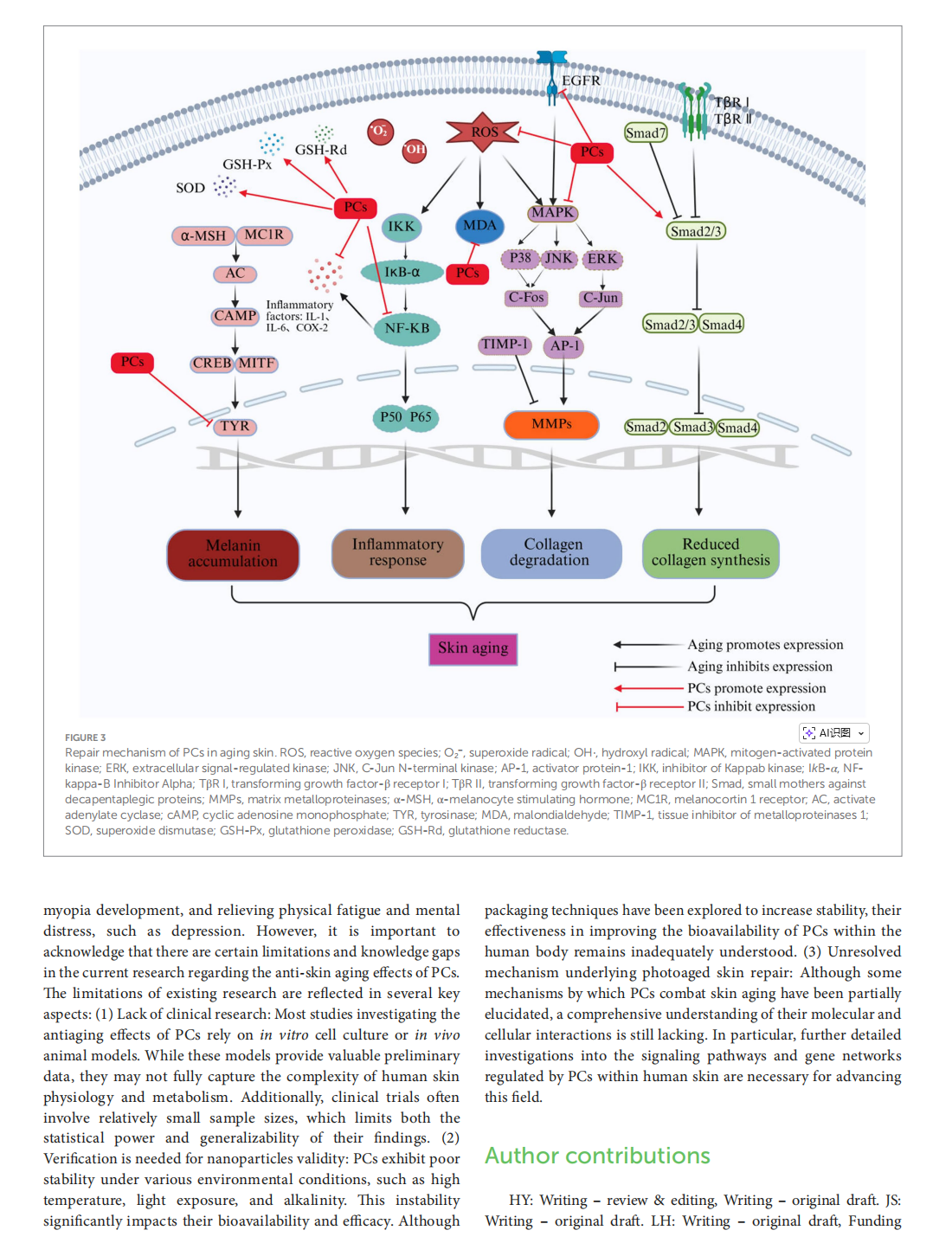




This article is excerpted from the 《Oxidants and Antioxidants in Medical Science》 by Wound World

- 星期三, 19 11月 2025
Cryptotanshinone protects skin cells from ultraviolet radiation-induced photoaging via its antioxidant effect and by reducing mitochondrial dysfunction and inhibiting apoptosis





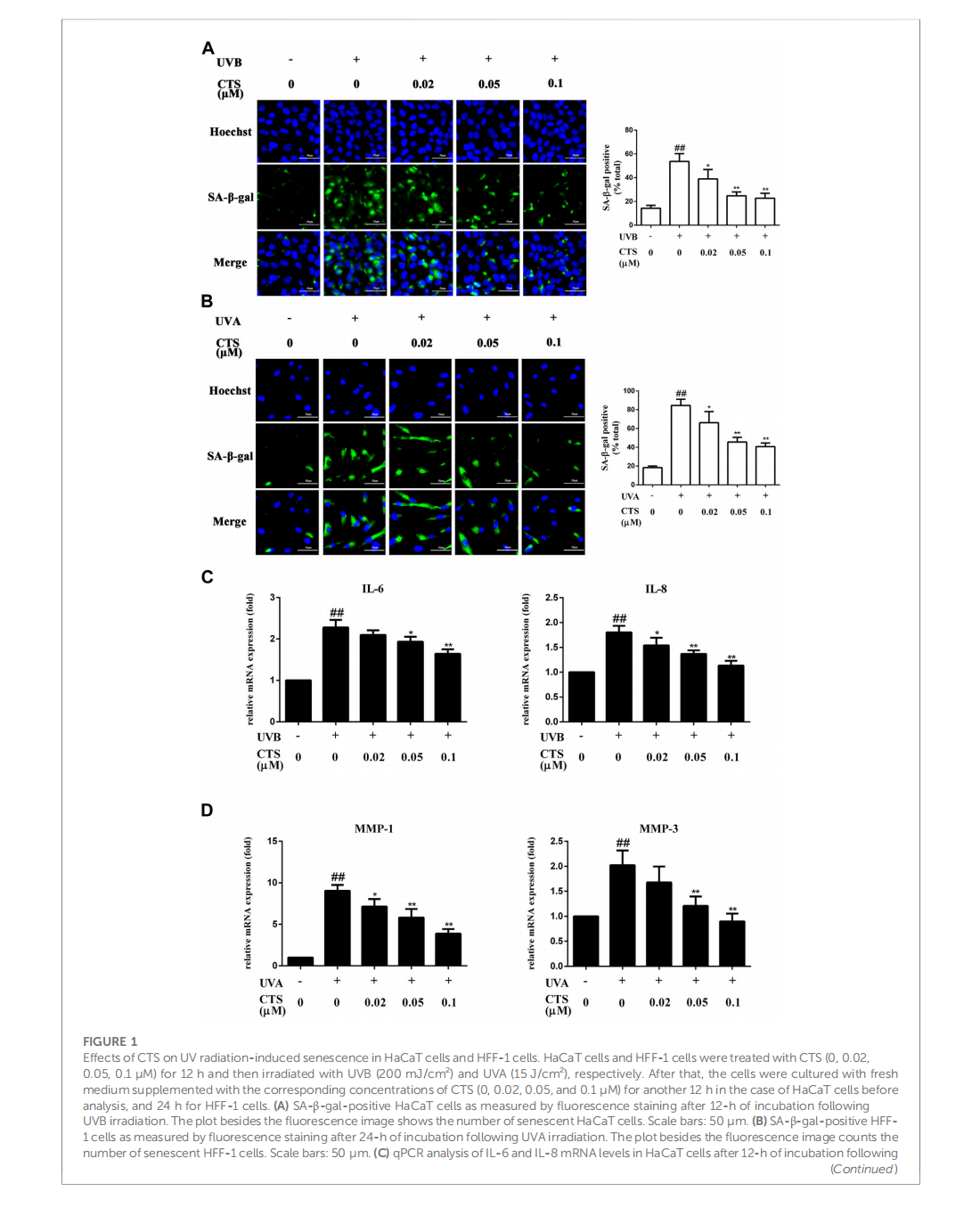

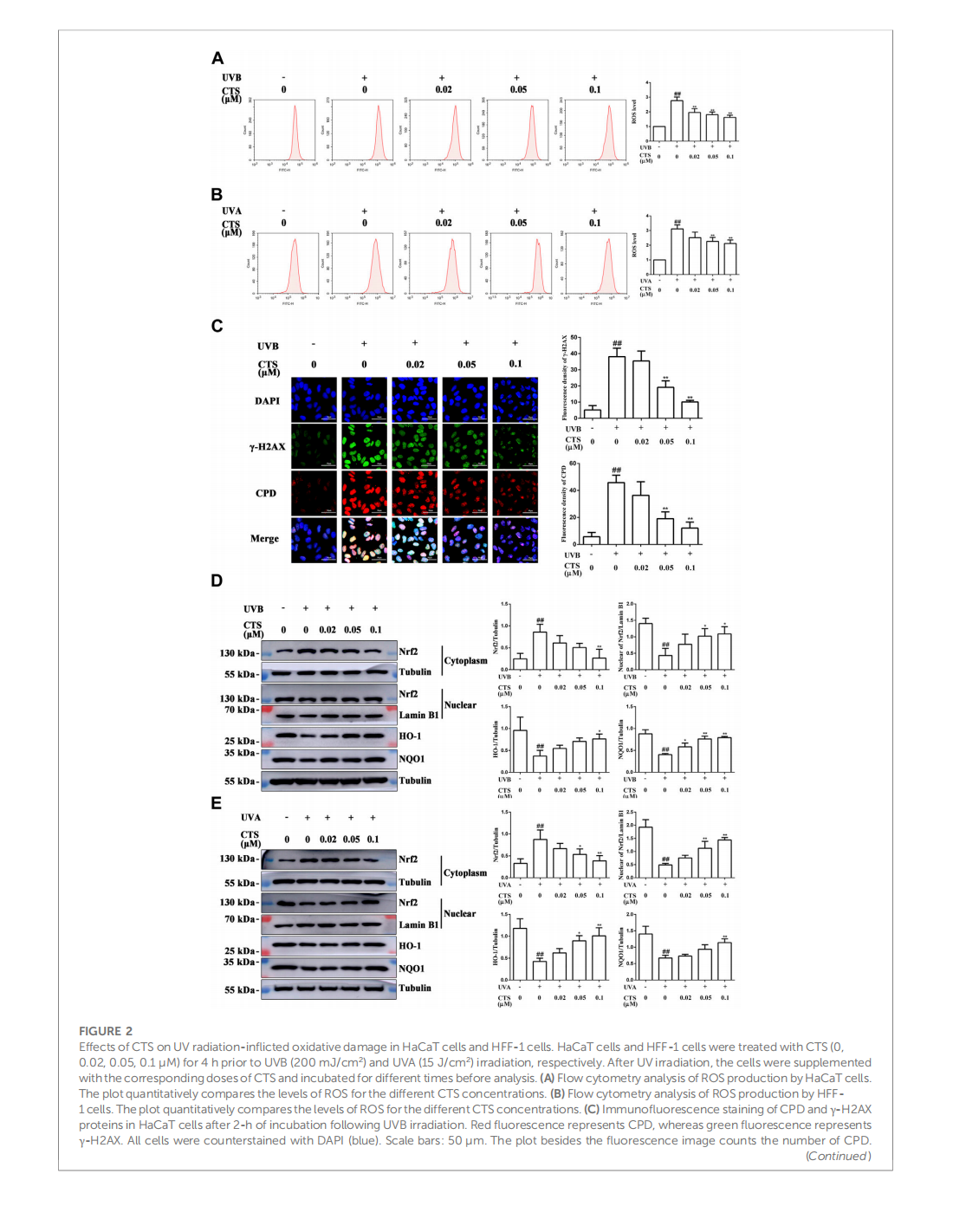

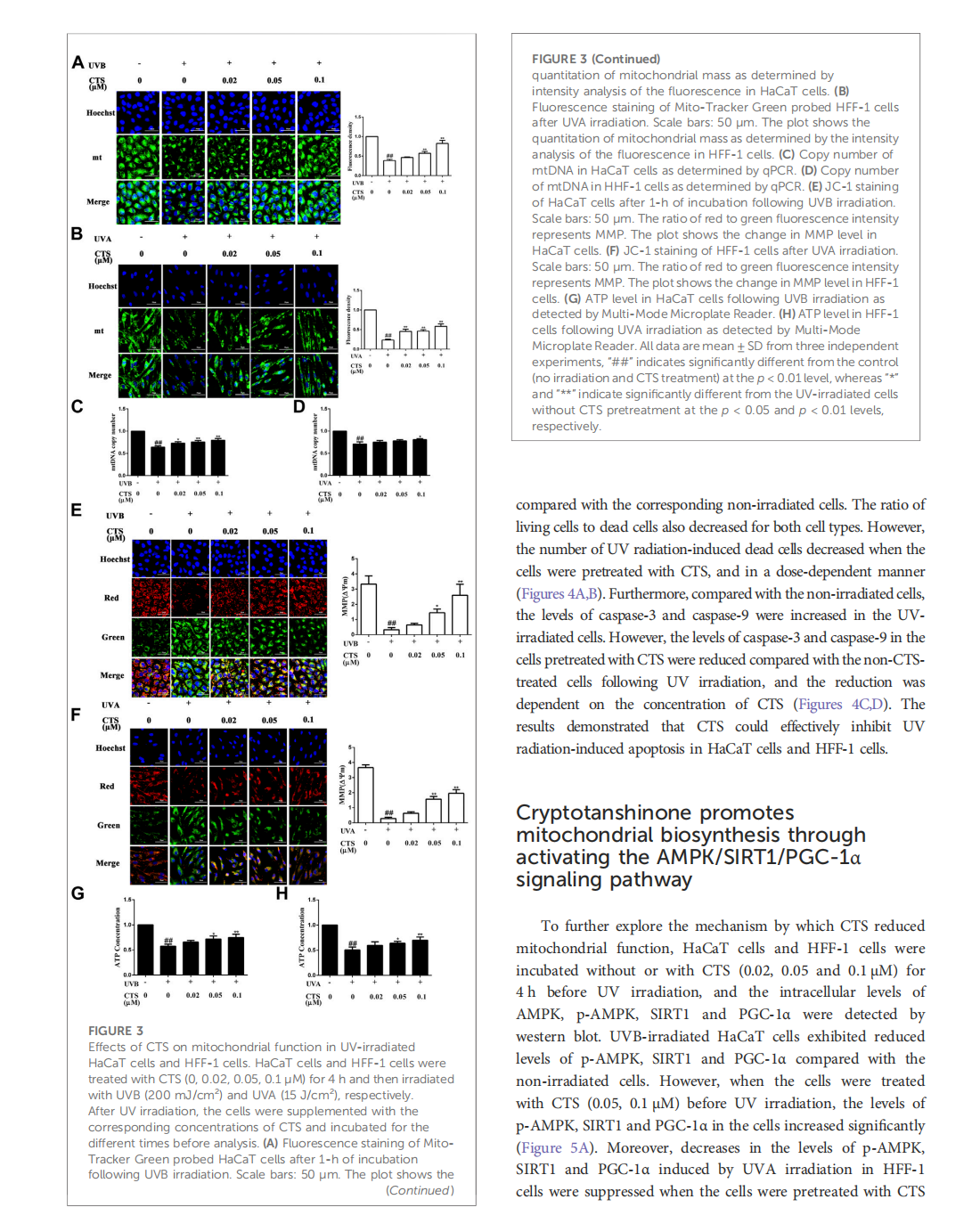
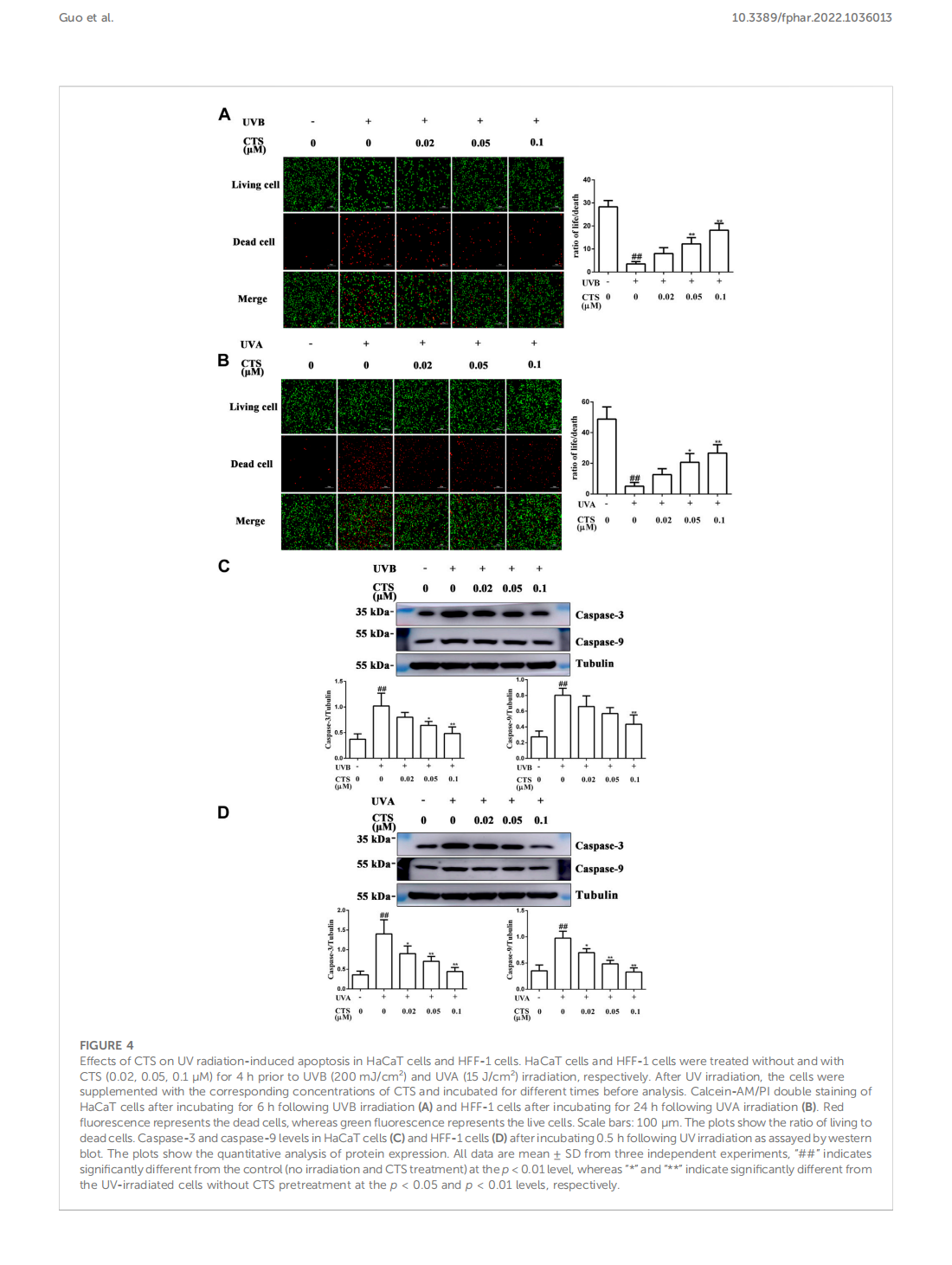
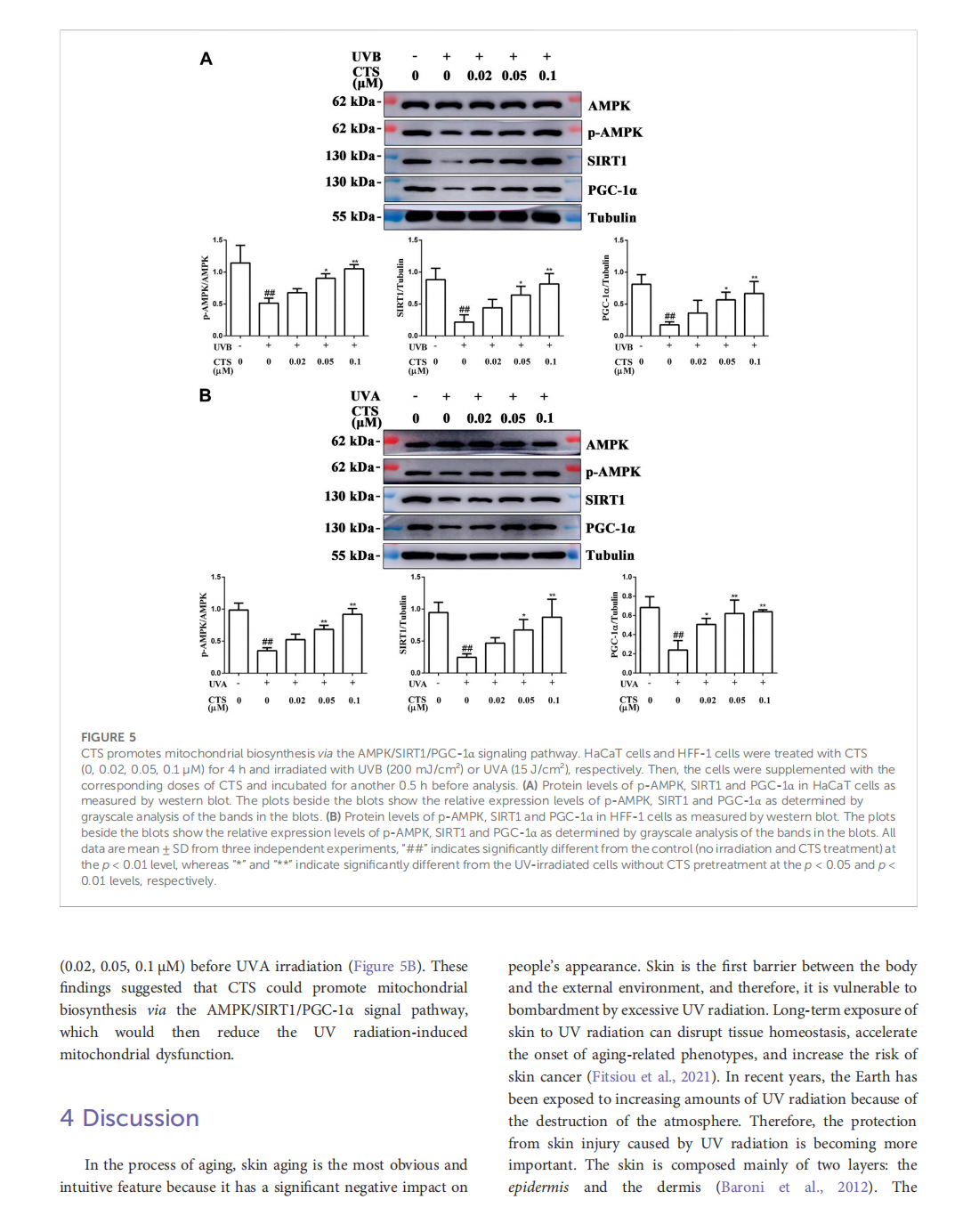





This article is excerpted from the 《Frontiers in Pharmacology》 by Wound World

- 星期二, 18 11月 2025
Toxicity Evaluation of TiO2 Nanoparticles on the 3D Skin Model: A Systematic Review



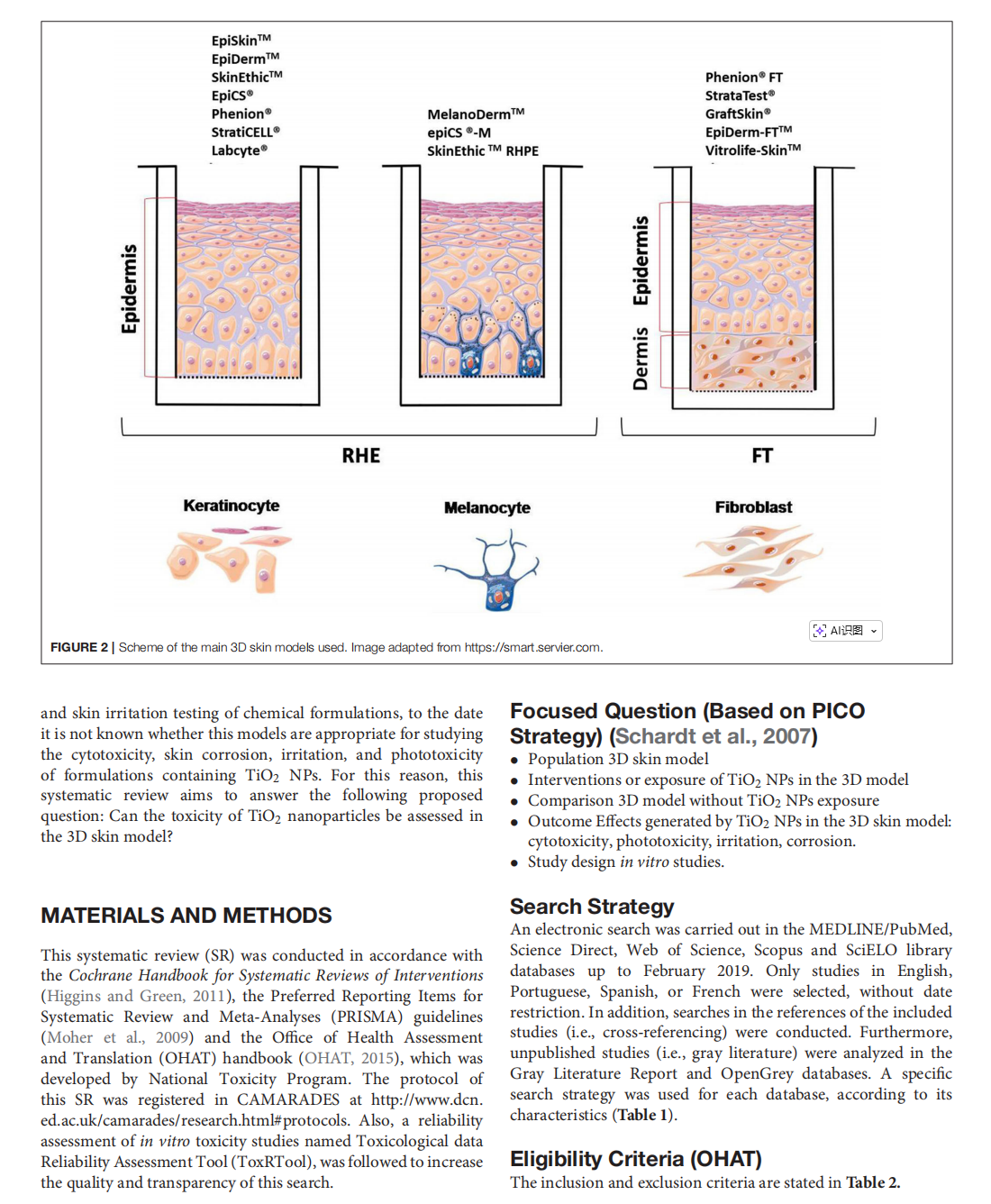



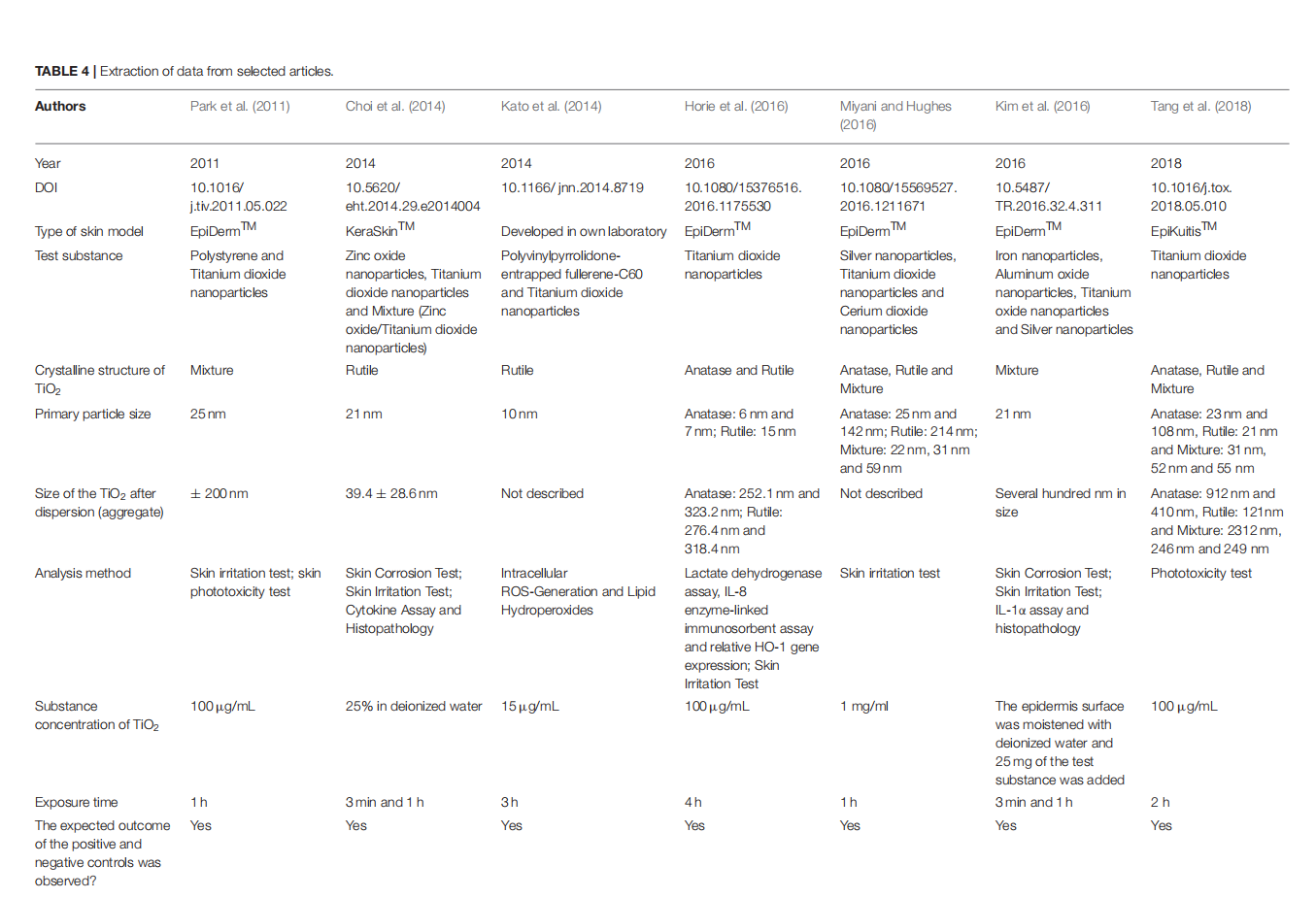
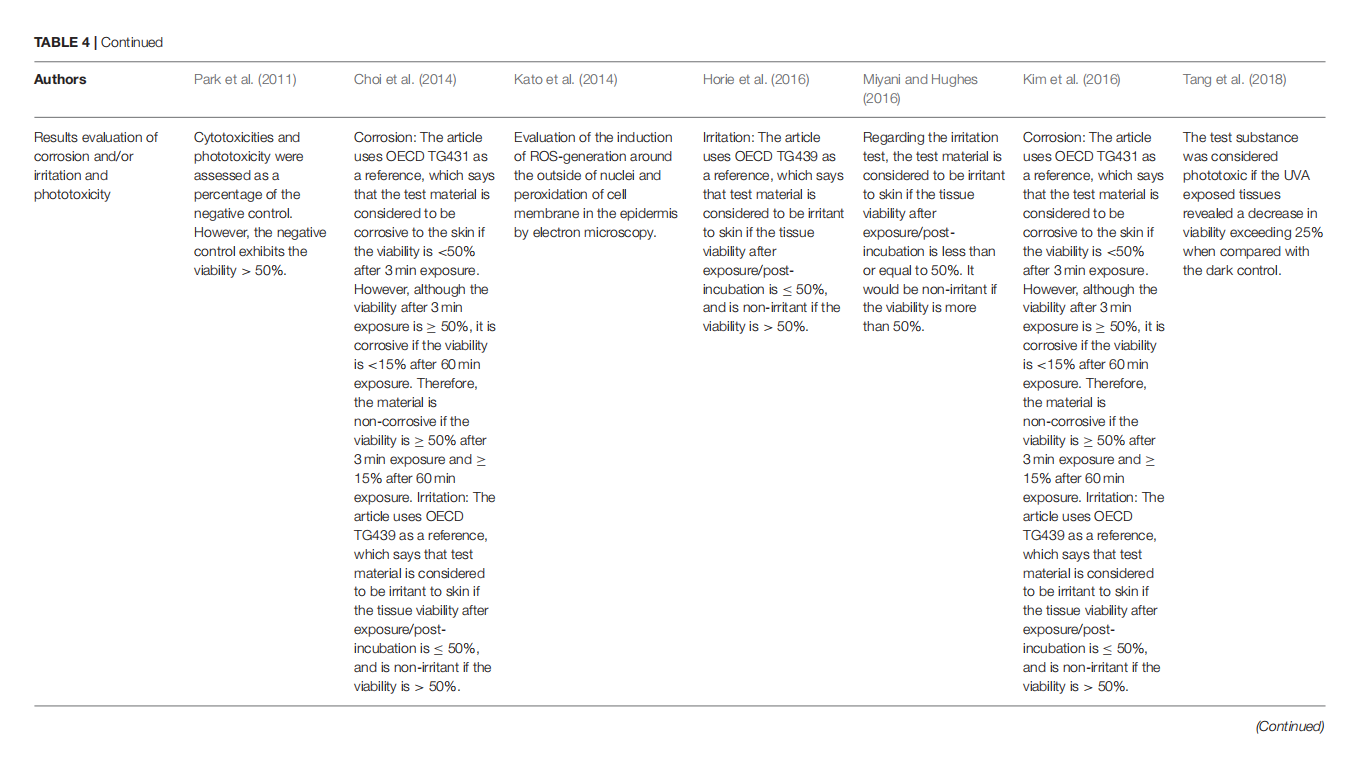






This article is excerpted from the《Journal of Toxicology and Environmental Health, Part B》 by Wound World

- 星期一, 17 11月 2025
Genetic profiling and precision skin care: a review


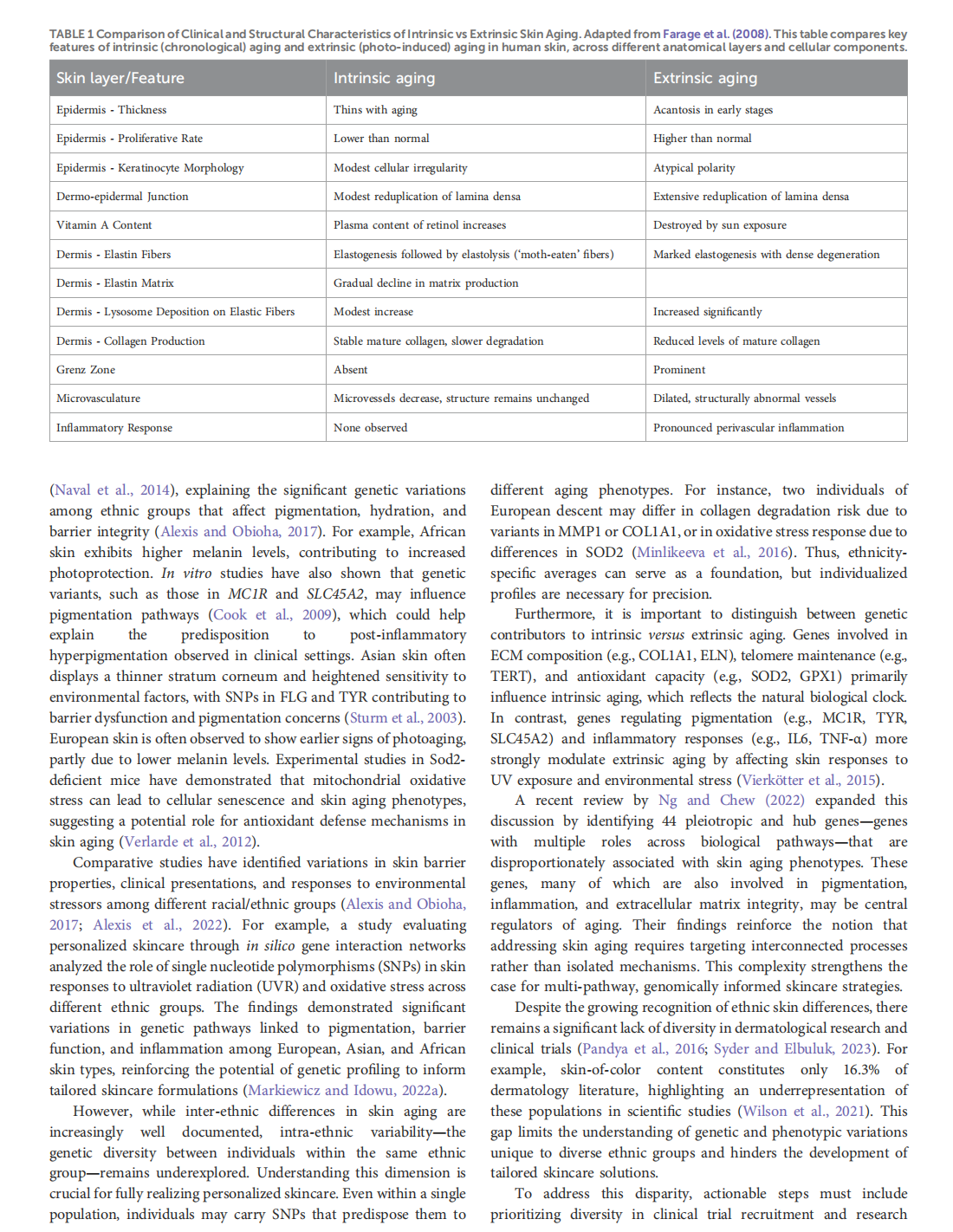




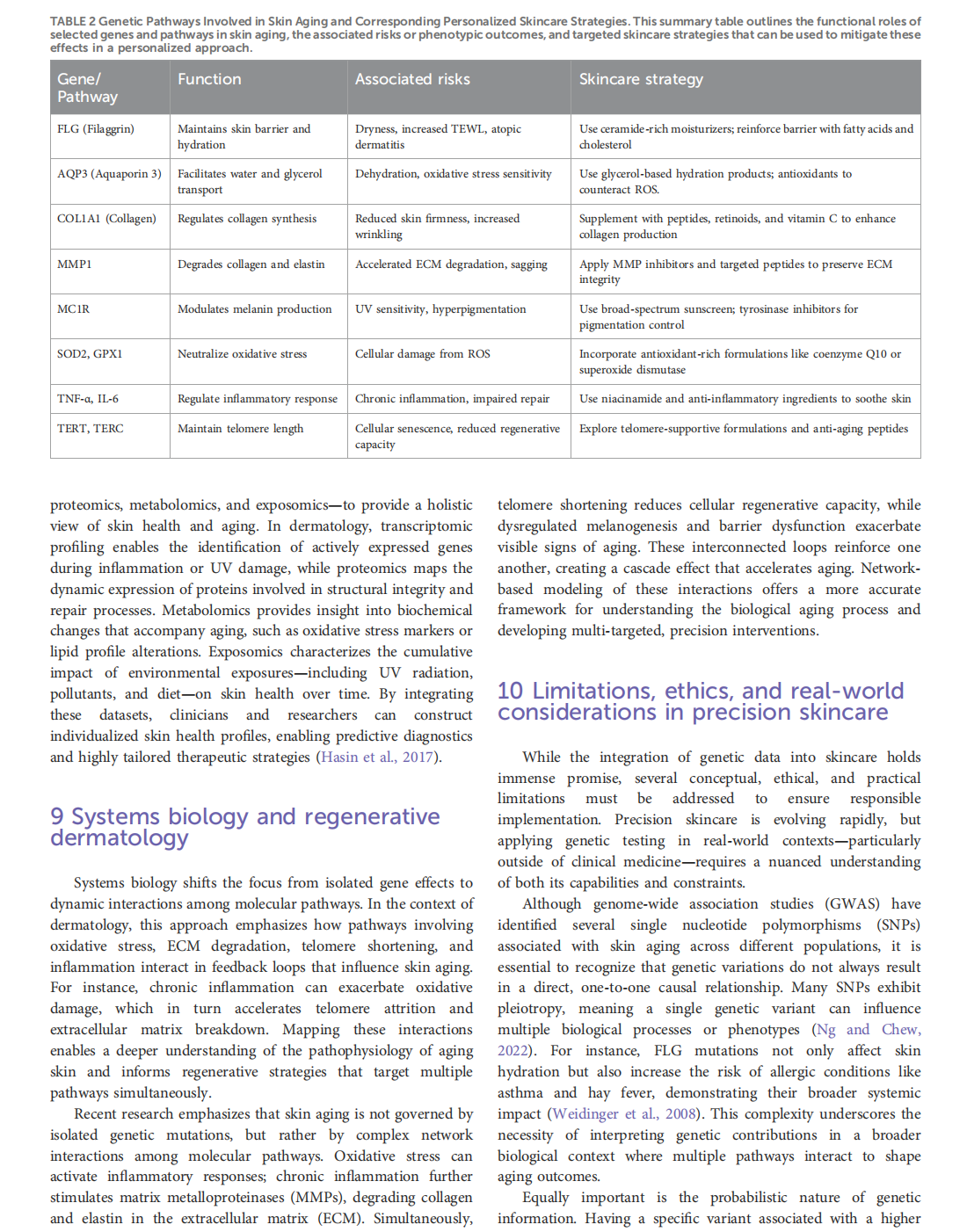




This article is excerpted from the《Frontiers in Genetics》by Wound World

- 星期五, 14 11月 2025
Nicotinamide Mononucleotide Attenuates Renal Interstitial Fibrosis After AKI by Suppressing Tubular DNA Damage and Senescence



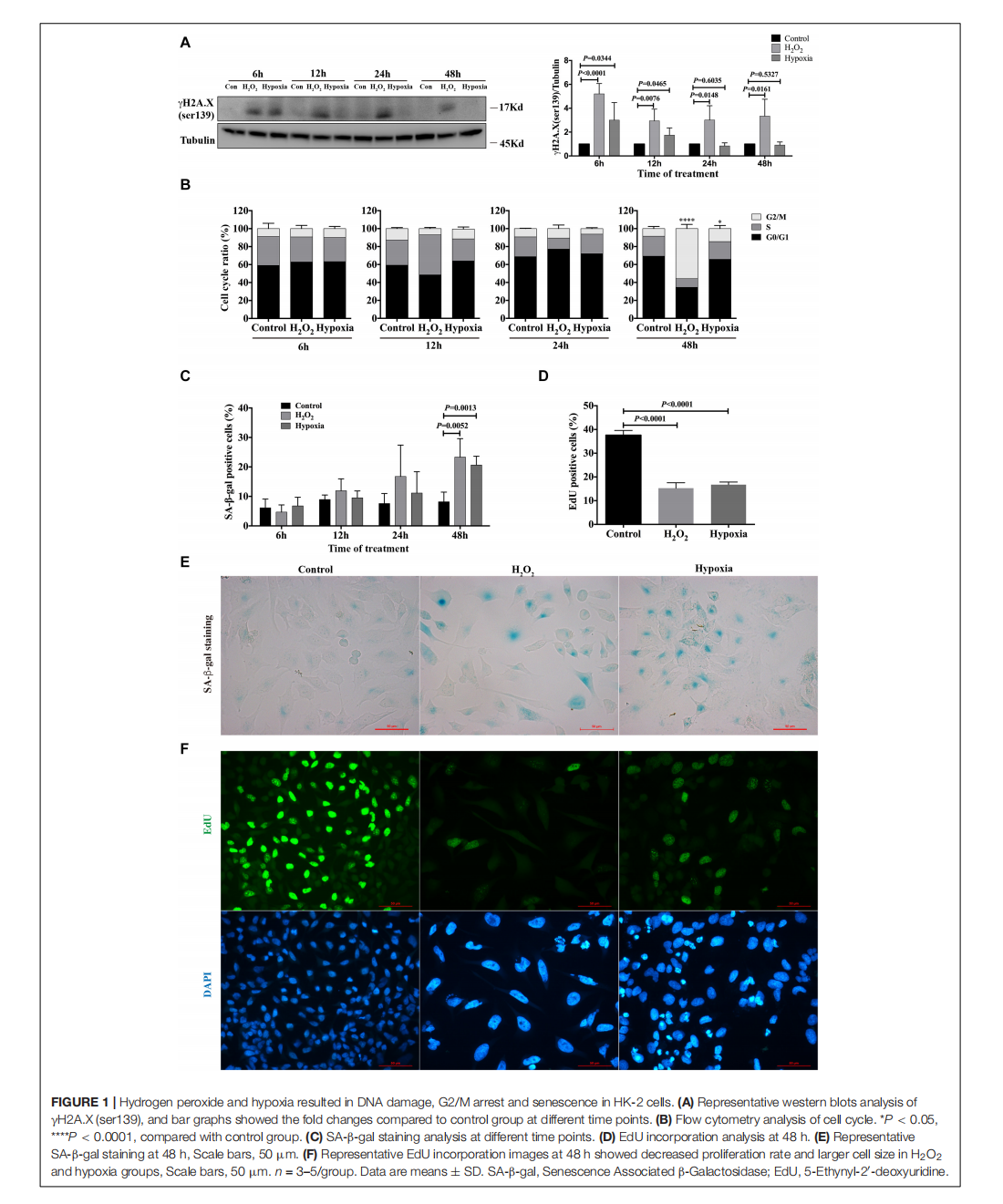

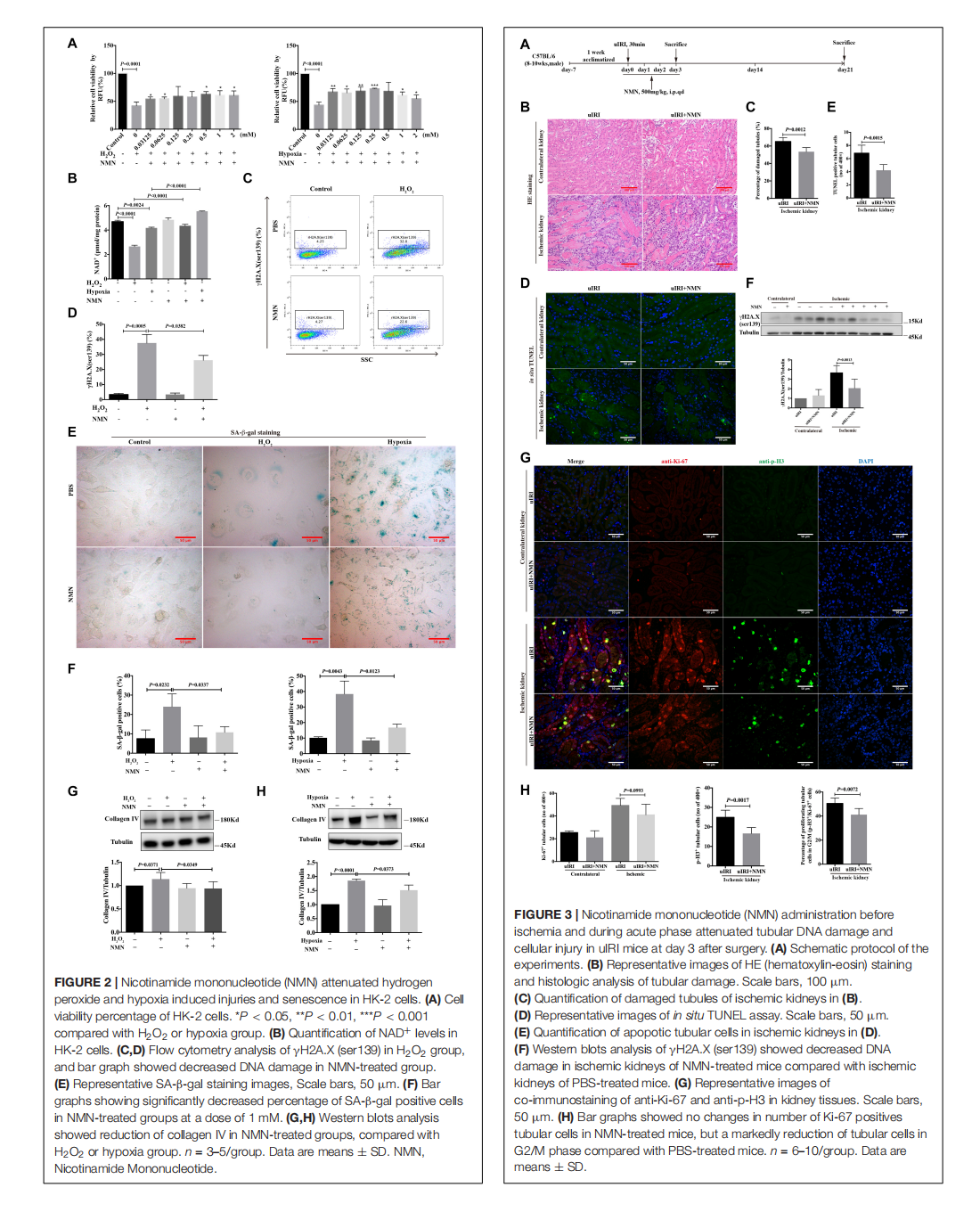
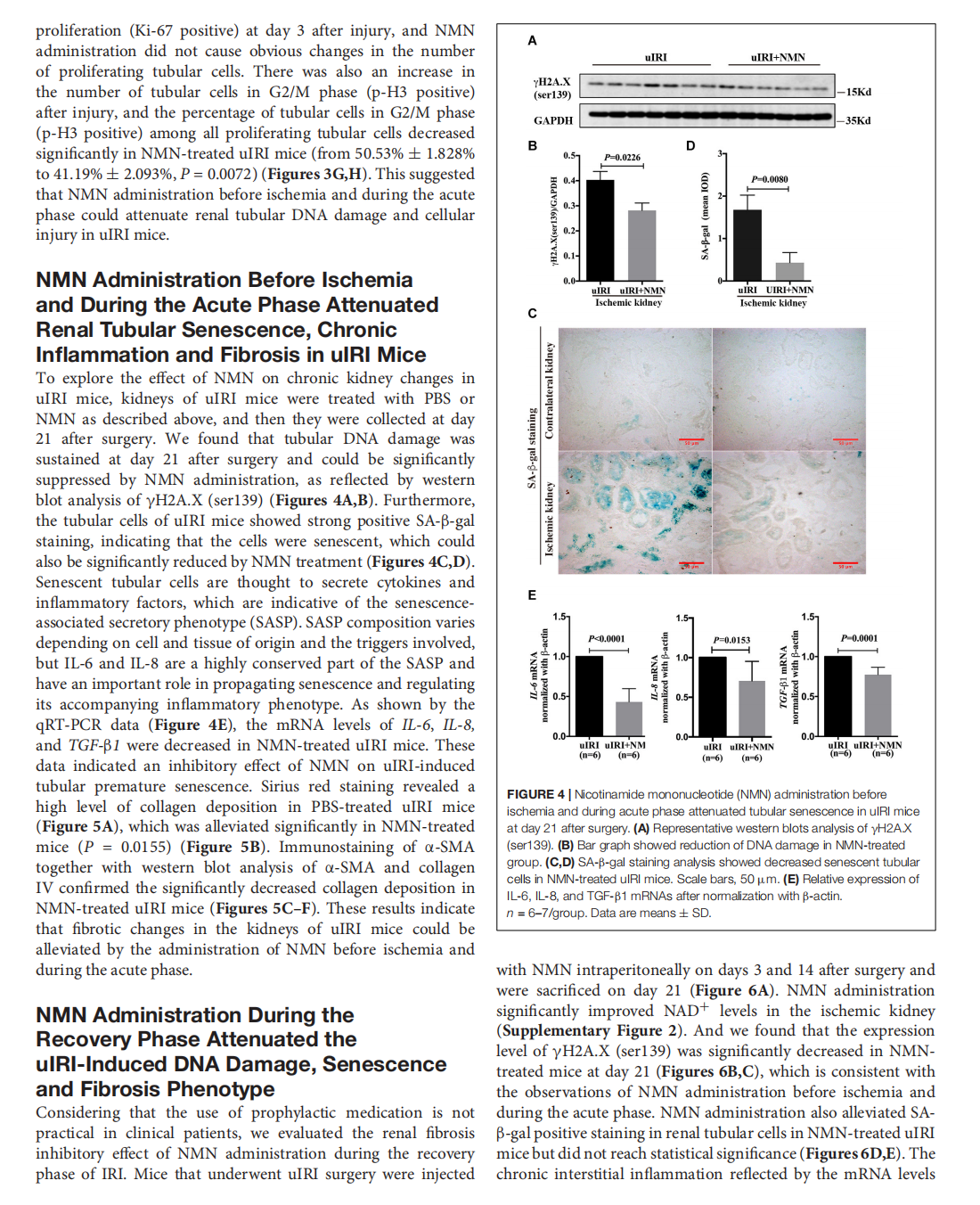
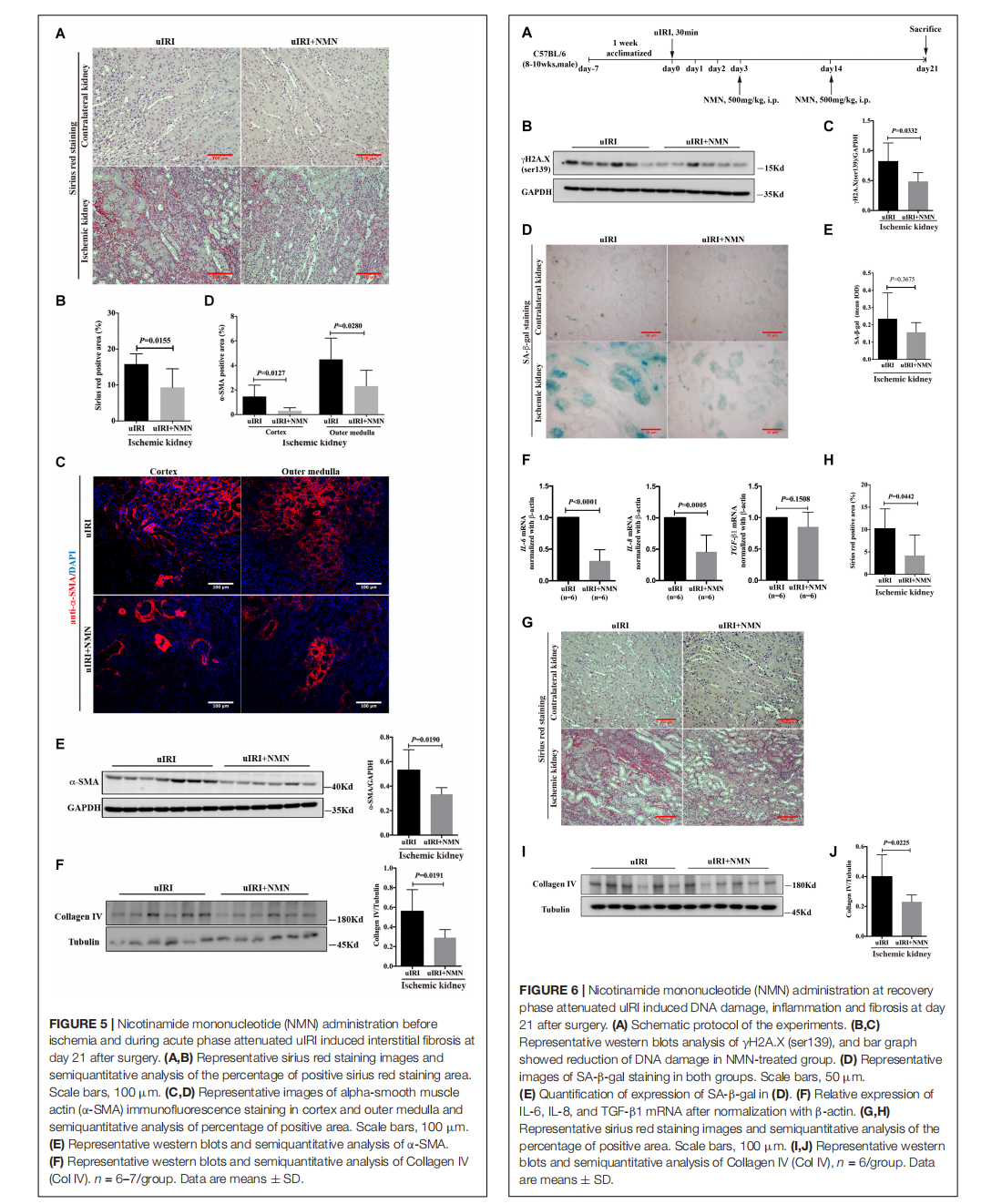



This article is excerpted from the 《Frontiers in Physiology》 by Wound World
